Zusammenfassung
Verschiebung des pH-Wertes; kommt Puffer als „Übeltäter“ infrage, so wären folgende drei Ursachen zu nennen: Falsch gewählter Puffer für den gewünschten pH-Wert, geringe Puffer-Konzentration sowie keine gleiche Konzentration von Säure (Base) und korrespondierendem Salz. In den beiden letzten Fällen ergibt sich ein schwacher Puffer.
Die nächsten zwei Punkte stellen zwar keine Fehler im engeren Sinne dar, sie sind dennoch Ursachen für mangelnde Reproduzierbarkeit: Verschiebung des pH-Wertes nach Zugabe des organischen Lösungsmittels und Änderung der Pufferstärke während eines Gradientenlaufs.
Der Fall
Sie übernehmen eine RP-HPLC-Methode, z.B. aus der Literatur, vom Kunden, von den Kollegen aus der Methodenentwicklung. Sie sind sicher, dass Sie keinen Fehler beim Ansetzen der mobilen Phase machen. Dennoch gibt es immer wieder Probleme mit schwankenden Retentionszeiten und/oder Peakflächen. Sie messen den pH-Wert des frischen Eluenten, dann wieder nach ca. 2-3 Stunden und auch den pH-Wert des Eluats (das, was von der Säule herauskommt). Sie erhalten unterschiedliche Werte, also bleibt der pH-Wert nicht konstant. Ergo: Der verwendete Puffer macht keinen guten „Job“. Wann ist dies der Fall?
Die Lösung
Nachfolgend die wichtigsten Ursachen:
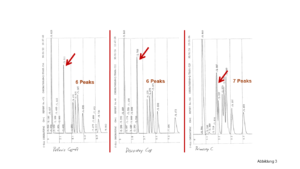
1. Der verwendete Puffer ist zu schwach: Je geringer die Konzentration, desto kleiner der pH-Wert-Bereich, in dem der Puffer für einen konstanten pH-Wert sorgen kann, siehe dazu Abbildung 1.
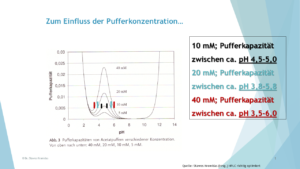
So reicht beispielsweise die Pufferkapazität eines 10 mM Acetat-Puffers aus, um einen pH-Wert-Bereich zwischen pH = 4,5-5,0 abzupuffern, ein 20 mM starker Puffer kann einen pH-Wert-Bereich zwischen pH = 3,8-5,8 und ein 40 mM starker Puffer schließlich einen pH-Wert-Bereich zwischen 3,5-6,0 abpuffern.
Ein weiterer Vorteil von konzentrierten Puffern ist die Verbesserung der Peakform, als Nachteil kann die verkürzte Lebensdauer der Säule sowie die bekannten Probleme mit der Pumpe genannt werden. Ein vernünftiger Kompromiss für kleine Moleküle sind oft 20 mM-Puffer, für Biomoleküle werden wesentlich konzentriertere Puffer benötigt.
- Nicht-passende Konzentration von vorliegendem Salz und zugegebener Base (Säure), um einen bestimmten pH-Wert einzustellen. Z. B. liegen 10 mM Natrium-Phosphat oder 10 mM NaOH vor und es wird eine stark-konzentrierte Phosphorsäure zur Einstellung des pH-Wertes verwendet. Die Menge an Salz (Base) ist zu gering, um die zugegebene Säure gänzlich „aufzufangen“, der resultierende Puffer ist demnach ebenfalls ein schwacher Puffer, der pH-Wert verschiebt sich.
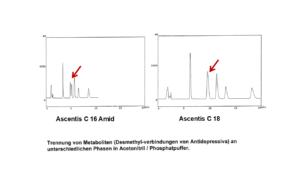
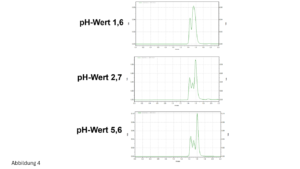
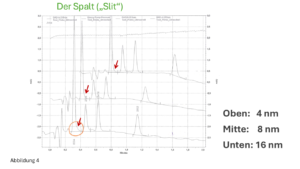
- Der verwendete Puffer passt nicht zu dem gewählten pH-Wert. Beispielsweise ist Phosphatpuffer für einen avisierten pH-Wert von 4 oder 5 nicht geeignet, er hat in diesem Bereich kaum eine Puffer-Kapazität, siehe Abbildung 2.
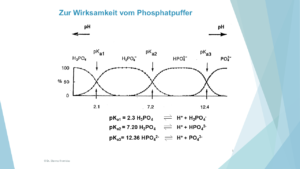
Der Phosphatpuffer ist geeignet für folgende drei pH-Wert-Bereiche (ca. +/- eine pH-Einheit um den jeweiligen pKS-Wert):
ca. 1,3-3,1
ca. 6,2-8,2
ca. 11,4-13,4
Nun die zwei weiteren Punkte:
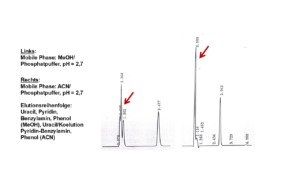
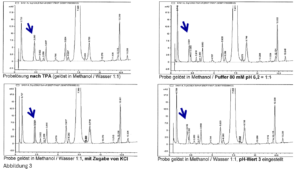
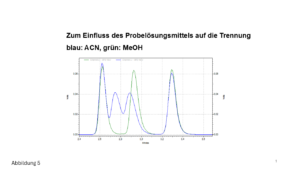
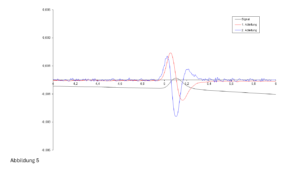
- Nach der Zugabe eines organischen Lösungsmittels ändert sich der pH-Wert – auch wenn ein richtiger Puffer in genügend starker Konzentration vorliegt, siehe Abbildung 3: Betrachten wir beispielsweise einen Phosphatpuffer mit einem pH-Wert von 7,0. Nach der Zugabe von 60 % MeOH ergibt sich ein pH-Wert von ca. 8,5. Auch wenn bei einem derart hohen MeOH-Anteil kaum vom „pH-Wert“ gesprochen werden kann (man müsste mit korrigierten Werten arbeiten …), können wir festhalten, dass der pH-Wert des Eluenten definitiv ins Alkalische driftet – die Säule hält nicht lang. Umgekehrt, liegt ein Puffer bei einem pH-Wert von ca. 9,2 vor, ergibt sich nach der Zugabe von Methanol eine (leichte) Abnahme des pH-Wertes (auf ca. 8,5). Mit ACN verhält es sich analog, die Verschiebung des pH-Wertes fällt allerdings geringer aus.

- Wenn Sie sich wirklich einen linearen, „klassischen“ Gradienten wünschen und keinen ungewollt dreifach-Gradienten (Lösungsmittelstärke, Salz, pH-Wert) fahren wollen und ferner eine quaternäre Pumpe zur Verfügung haben, könnten Sie folgenden Trick anwenden:
Kanal A: Wasser
Kanal B: ACN
Kanal C: Puffer, er wird mit 10 % der Gesamtflussrate gefördert, Pufferkonzentration: 10-mal die Endkonzentration im Eluenten, der Gradient wird wie gewohnt gemischt.
Das Fazit
Einer unbeabsichtigten Verschiebung des pH-Wertes kann durch
– den richtigen Puffer (abhängig vom gewünschten pH-Wert-Bereich)
– einen genügend stark konzentrierten Puffer
– sowie einen Puffer, eingestellt mit gleicher Molarität an korrespondierendem Salz
(Base) und Säure
begegnet werden.
Ferner sollte an die Verschiebung des pH-Wertes beim Gradienten durch die stete Zunahme des organischen Anteils im Eluenten sowie an eine evtl. gleichzeitige Änderung der Pufferkonzentration gedacht werden. Die Konsequenzen bei einer unbeabsichtigten Verschiebung des pH-Wertes können vielfältig sein: Verschiebung der Retentionszeit, Veränderung der Peakform, Veränderung der Peakfläche. Und eine solche Verschiebung/Veränderung kann je nach Struktur der Analyten von marginal bis gravierend ausfallen. Auch eine Änderung der Elutionsreihenfolge kommt nicht selten vor.