Der Fall
Nehmen wir an, Sie haben recht viele, recht ähnliche Komponenten zu trennen. In einem solchen Fall ist eine ausreichende Selektivität – also unterschiedlich starke Wechselwirkungen der einzelnen Komponenten mit der stationären Phase – realistischerweise kaum erreichbar. Der einzige Ausweg lautet: Eine möglichst gute Peakkapazität, also maximal mögliche Anzahl Peaks pro Zeiteinheit. Wie ist dies zu erzielen?
Die Lösung
Es gibt mehrere Formeln für die Peakkapazität, die zwei einfachsten sind folgende:
nC = tRl – tRf / w und
nC = tG / w
mit:
nC: Peakkapazität
tRl: Retentionszeit des letzten Peaks
tRf: Retentionszeit des ersten Peaks
tG: Gradientendauer
w: Peakbreite
Was heißt das nun?
Vereinfacht folgendes: Ich brauche eine große Differenz zwischen der Retentionszeit des letzten und des ersten Peaks und die Peakbreite soll möglichst klein sein.
Diese allgemeine Forderung ist „zeitlos“, gilt für alle Gradientenarten und ist auch unabhängig davon, ob es sich um kleine oder große (Bio)Moleküle handelt. D. h. sie ist anwendbar sowohl imfalle von RP-Trennungen als auch beispielsweise bei Ionenaustauschertrennungen von Oligonucleotiden mittels Salz- bzw. pH-Wert-Gradienten.
Was braucht man also?
* Einen langen Gradienten und einen hohen Fluss (großes Gradientenvolumen)
* Eine lange, möglichst dünne Säule (große Retentionszeitdifferenz letzter/ertster
Peak, maximal erreichbare Auflösung aufgrund des geringen
Säuleninnendurchmessers der Säule)
* Kleine Teilchen sind nur bei wirklich sehr schwierigen Trennungen notwendig (schmale Peaks)
* Imfalle von „unproblematischer“ Matrix: Kein poröses, sondern Core Shell-Material (schmale Peaks)
* Höhere Temperaturen (schmale Peaks)
* Einen hohen Start- und einen hohen End % B (schmale Peaks)
* Bei großen Molekülen, tendenziell kleine Flussraten: Aufgrund der Molekülgröße ist
deren Kinetik bei der Desorption von der Oberfläche der stationären Phase langsam
(großer C-Term der Van-Deemter-Gleichung); der kleine Fluss führt zu einer
guten Effizienz (große Bodenzahl) und somit zu schmalen Peaks und folglich zu einer kleinen Peakbreite
Nachfolgend vereinfachte Empfehlungen, die sich aus eigenen, zahlreichen Experimenten zur Gradientenoptimierung mit Focus Peakkapazität herauskristalisiert haben:
– Start mit 30-40 % B; streben Sie ferner eine Mindestdifferenz zwischen Anfangs- und
End % B von ca. 40 %, eher von ca. 60 % B
– Fluss bei posösen Teilchen 2 ml/min, bei Core Shell 1-1,5 ml/min, bei großen
Molekülen 0,8-1 ml/min; bei sehr langsamer Kinetik durchaus 0,15-0,35 ml/min
– Kleine Teilchen (1,7-1,9 µm) sind nur bei sehr anspruchsvollen Trennungen
vonnöten, nur in solchen Fällen spielen im Gradientenmodus die kleinen Teilchen ihre
Vorteile aus – aber dann schon „ordentlich“!
– Benötigtes Gradientenvolumen (beispielhaft):
* 30 ml (z. B. 2 ml/min, Gradientendauer 15 min) für ca. 30-40 Peaks
* 40 ml für ca. 40-50 Peaks
– Säulendimesionen (beispielhaft):
* 150 mm x 2,1 mm für ca. 50-60 Peaks
* 250 mm x 2,1 mm für ca. 60-80 Peaks
Das sind relativ einfach zu erzielbare Ergebnisse; natürlich sind noch „bessere“ Ergebnisse möglich, wenn weitere Möglichkeiten der Optimierung zunutze gemacht werden, hier zwei Beispiele:
– 300 x 2,1 mm-Säule im UHPLC-Modus und/oder Verwendung von Core-Shell-
Material
– Konkaves Gradientenprofil
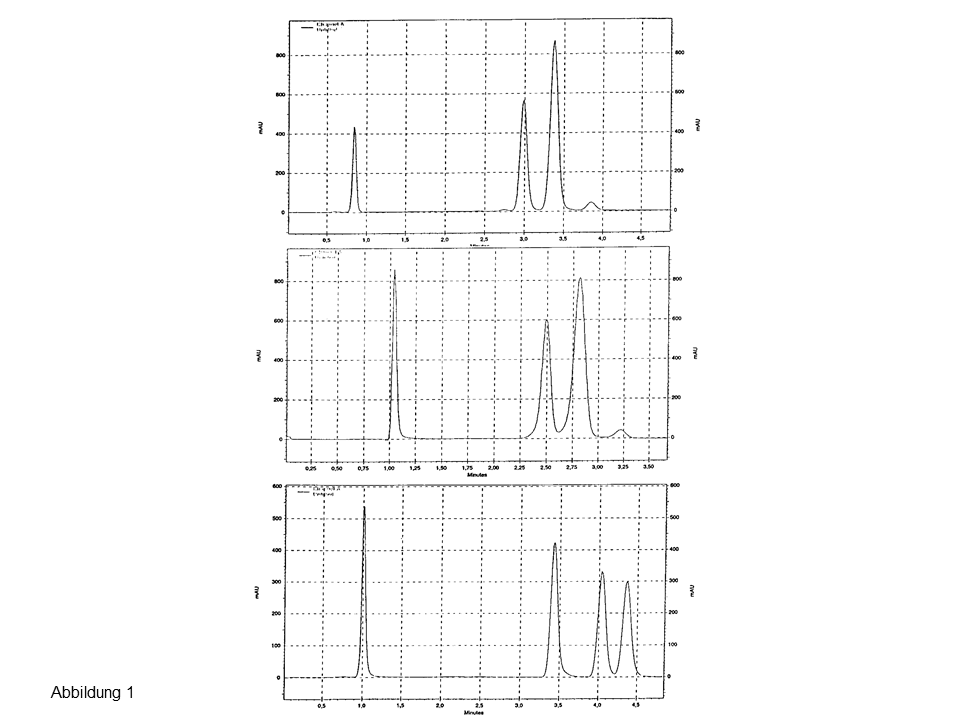
Sind mehr als 100 Peaks zu trennen, ist die serielle Kopplung von langen, dünnen Säulen die beste Möglichkeit (sofern man bei 1-dimensionalen Trennungen bleiben möchte), die maximal-mögliche Peakkapazität zu erreichen. In Abb. 1 werden zwei 600 mm x 2,1 mm-Säulen gezeigt, die für solche Trennungen benutzt wurden.

Zum Schluss zwei Beispiele, die das weiter oben aufgeführte untermauern:
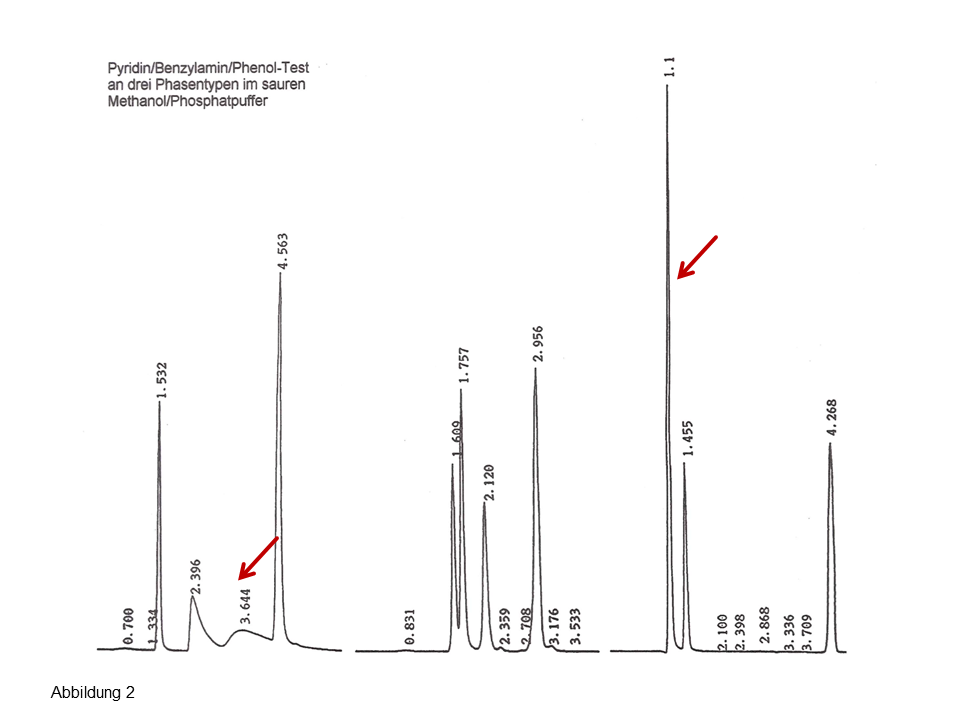
In Abb. 2 wird einer Trennung aus den 1980er Jahren aus einem Bayer-Labor in Dormagen gezeigt: Bei einem Gradientenvolumen von ca. 36 ml sind an einer 200 x 3 mm ca. 60 Peaks von großen Molekülen (Ethylenglykolpolyadipat) zu trennen.

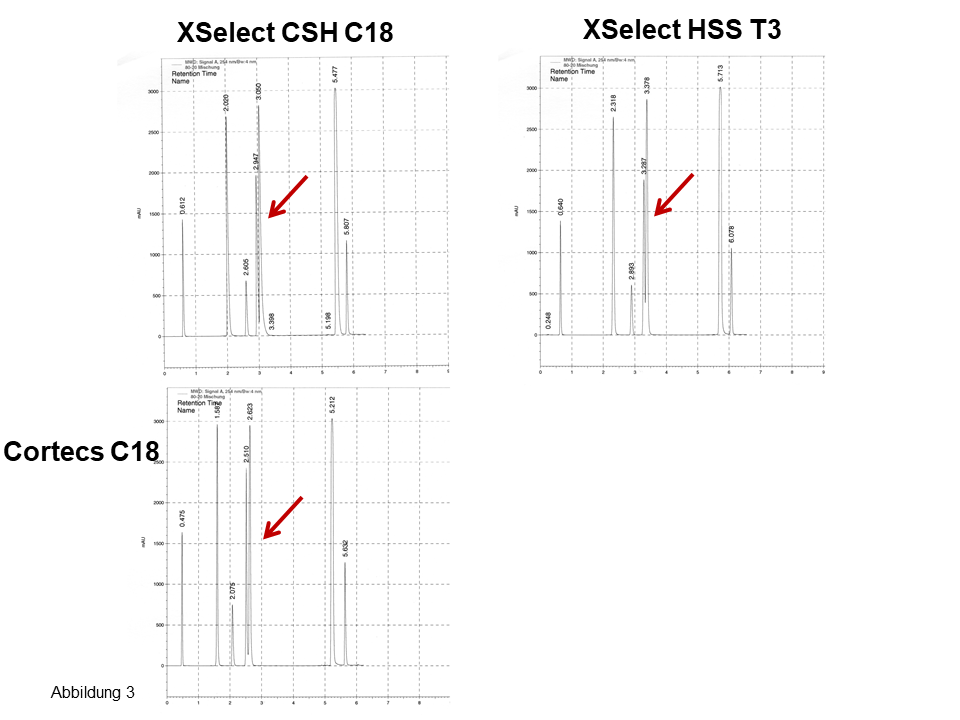
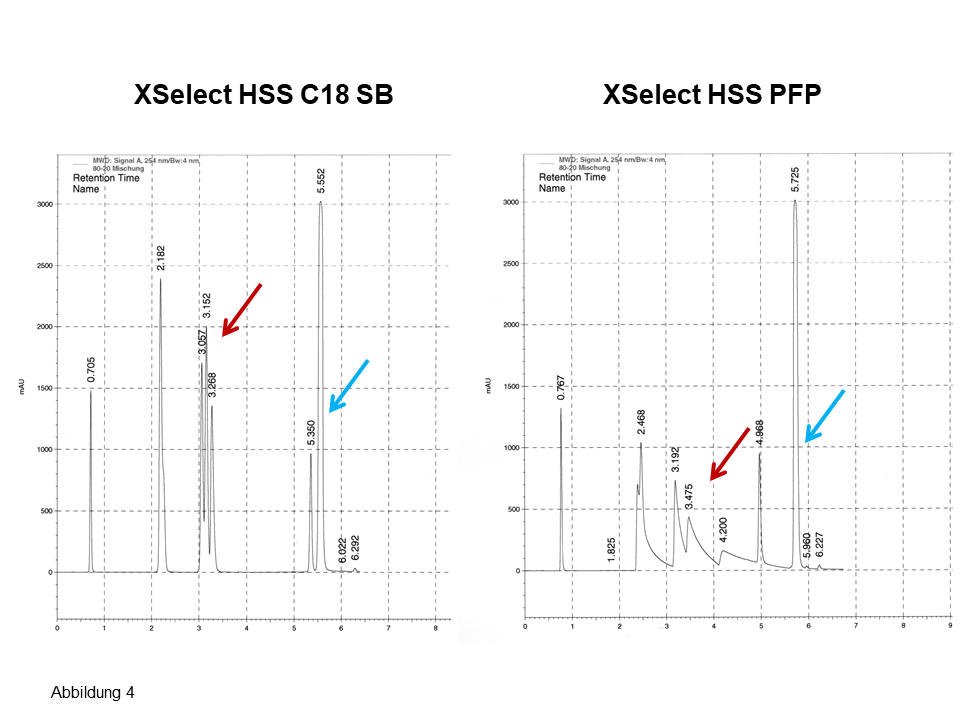
In Abb. 3 wird ein Beispiel von ThermoScientific gezeigt: Bei einem Gradientenvolumen von ca. 13 ml und Verwendung eines konkaven Gradienten sind an einer 250 x 4 mm-Säule in ca. 14 min 56 Nucleotide und 12 Varianten zu trennen.

Das Fazit
Für eine gute Peakkapazität wird eine lange, möglichst dünne Säule und – sofern die Molekülstabilität es erlaubt – eine höhere Temperatur benötigt. Das notwendige Gradientenvolumen hängt von der Anzahl der zu erwarteten Peaks ab. Dieses ist über die Gradientendauer oder – bei kleinen Molekülen und keiner zu langsamen Kinetik oft sinnvoller – über den Fluss einzustellen. Ein tendenziell hoher % B zu Beginn, d. h. direkt eine erhöhte Elutionskraft, „schiebt“ die Peaks nach vorne und die dadurch resultierende schmale Peakform begünstigt eine gute Peakkapazität. Kleine Teilchen sind schließlich nur dann zu empfehlen, wenn die Herausforderung groß ist und der resultierende Druck keine große apparative Probleme bereitet. Eine moderne Anlage mit einem möglichst kleinen Dispersionsvolumen ist zweifelsohne von Vorteil.
Zusammengefasst sollte für eine zu erwartete Zahl von 50 und mehr sehr ähnliche Komponenten folgendes angestrebt werden:
Säulenlänge: 150-250 mm
Säuleninnendurchmesser: 2,1–3 mm
Teilchengröße: 1,7-1,9 µm poröses bzw. 2,5-2,7 µm Core Shell Material
Temperatur: 70-90 °C (Probestabilität?!)
Fluss: Bei großen Molekülen und/oder dualem Mechanismus (langsame Kinetik) nicht höher als 1 ml/min, mitunter 0,3-0,4 oder sogar 0,15-0,20 ml/min