Der Fall
In den letzten Jahren wurde eine Reihe moderner C18- sowie polarer RP-Phasen eingeführt. Da wären beispielhaft zu nennen: Chemisch geschützte („embedded“ phases), hydrophil endcappede sowie Mixed Mode Phasen und was die Matrix betrifft: Hybrid-, Core Shell- oder monolithische Phasen. Diese Materialien weisen vielfach Vorteile auf. Heißt es nun, dass bei der Entwicklung einer neuen Methode der Einsatz einer solchen modernen Phase die richtige Wahl wäre? Sollte man also nicht-endcappede Phasen als eine alte Technologie „ad acta“ legen?
Die Lösung
Nein. Für die Trennung von Substanzen mit ähnlicher Hydrophobie, aber mit Unterschieden in der Anordnung von Substituenten am Molekül oder von Doppelbindungen in einer Seitenkette (α, β-Isomerie, Stellungsisomerie) oder stark polare Komponenten sind Restsilanolgruppen für die Selektivität sehr wichtig. Dies wird an drei Beispielen demonstriert:
Beispiel 1: Trennung von Steroiden
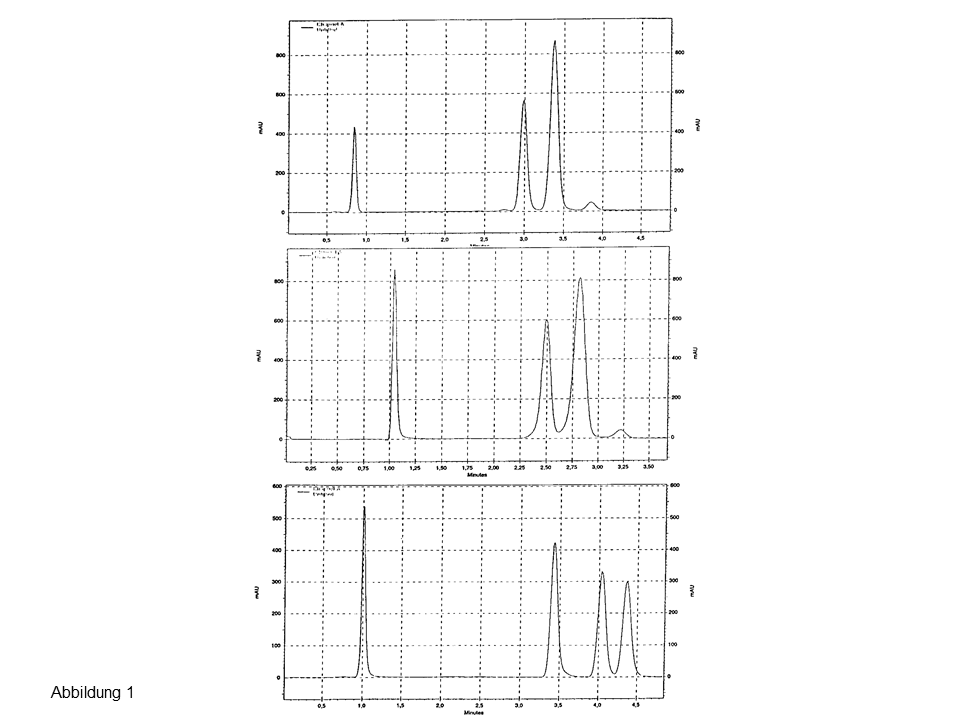
Abb. 1: Trennung von drei Steroiden an zwei endcappeden (oben, Mitte) und an einer nicht endcappeden C18-Phase (unten), Erläuterungen siehe Text.
Das obere und mittlere Chromatogramm zeigen die Injektion von drei Steroiden (α, β-Isomere) an zwei modernen, hydrophoben Phasen. Steroid Nr. 2 und 3 koeluieren. Die Trennung gelingt an Resolve C18, einem älteren, nicht endcappeden Material, siehe unteres Chromatogramm in Abbildung 1.
Beispiel 2: Trennung von starken Basen
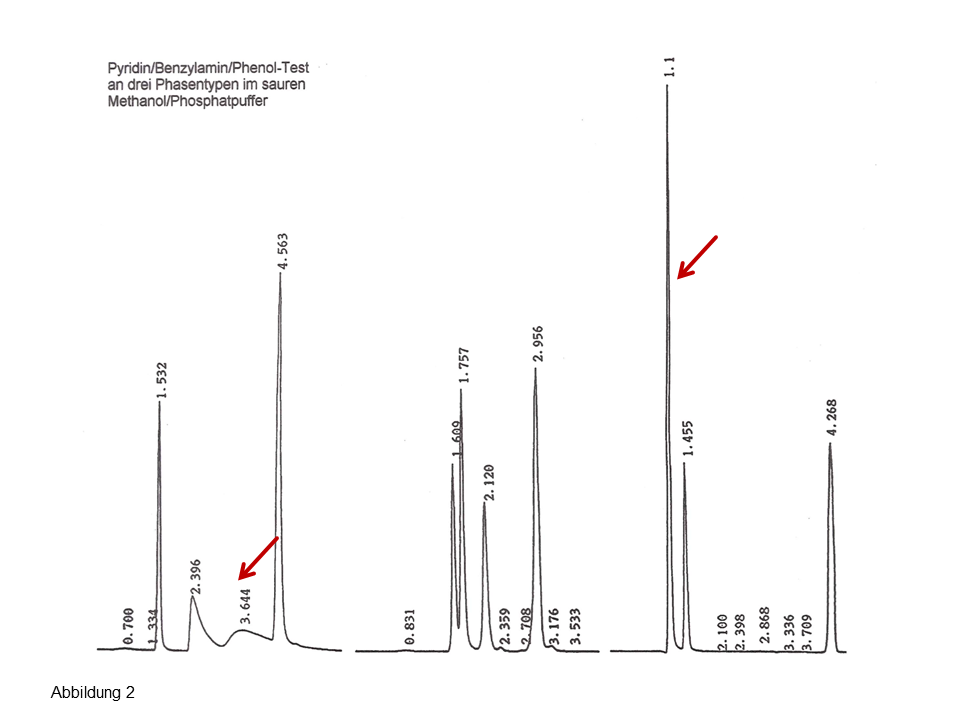
Abb. 2: Injektion einer Mischung von drei polaren Komponenten auf eine silanophile (links) und eine hydrophobe, endcappede C18-Phase (rechts), Erläuterungen, siehe Text.
Auf der rechten Seite der Abbildung 2 wird die Injektion von Uracil (inerte Komponente), Pyridin, Benzylamin und Phenol an einer modernen endcappeden C18-Säule gezeigt. Die zwei Basen koeluieren (erster Peak), was vollkommen nachvollziehbar ist: Man kann nicht erwarten, dass eine hydrophobe, gründlich endcappede Phase eine gute polare Selektivität aufweist. Und das kann zu falschen Schlussfolgerungen führen: Eine gute Peaksymmetrie suggeriert im Routinealltag eine gute Selektivität… Das linke Chromatogramm zeigt die Injektion auf eine „alte“, stark silanophile Phase, Hypersil ODS, das Ergebnis lautet: Eine hervorragende Selektivität für die zwei starke Basen bei gleichzeitig sehr langsamen Kinetik (starkes Tailing). Dass weitere polare Phasen wie beispielsweise eine C7-fluorierte Phase eine ebenso gute Selektivität aufweist (siehe mittleres Chromatogramm) versteht sich von selbst.
Beispiel 3: Injektion einer Mischung diverser Komponenten inkl. drei Isomeren (o-, m-, p-Toluidin)
An mehreren Säulen von Waters erhält man nahezu das gleiche Bild, die Chromatogramme sehen recht ähnlich aus, für die drei Isomere ergeben sich zwei Peaks, siehe Pfeile in Abbildung 3. Erst beim Einsetzen einer nicht-endcappeden Phase (Abbildung 4) sind für die drei Isomere drei Peaks zu sehen. Ferner: Betrachte bei den letzten zwei Peaks die Elutionsumkehr. Auch hier: Eine fluorierte Phase (Abbildung 4, rechts) zeigt eine noch bessere polare Selektivität bei einer noch langsameren Kinetik, siehe dazu das auffallend starke Tailing.
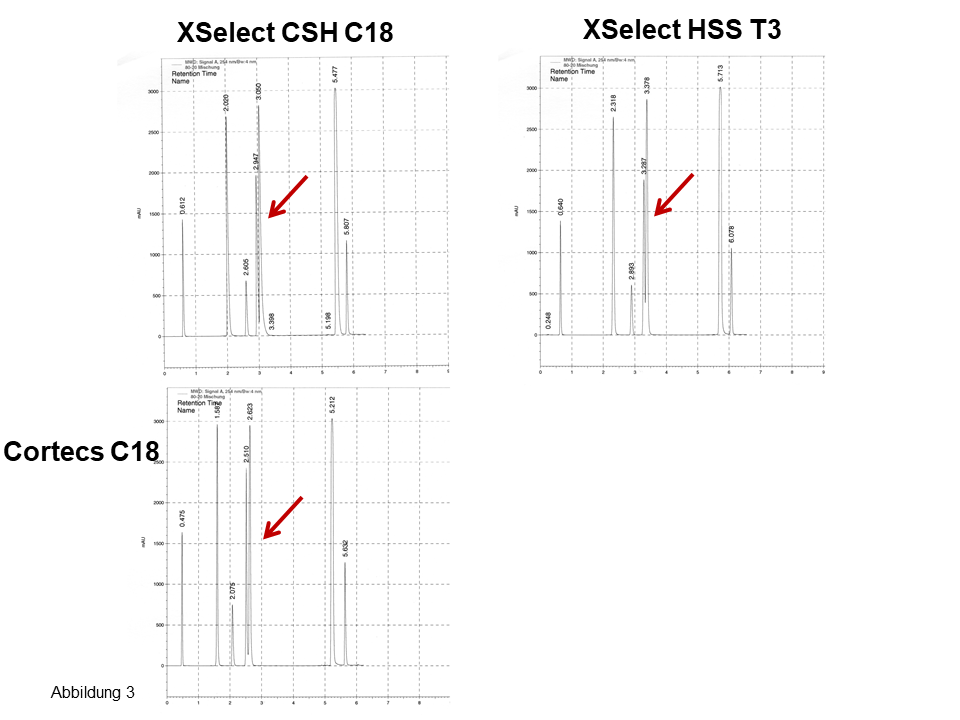
Abb. 3 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
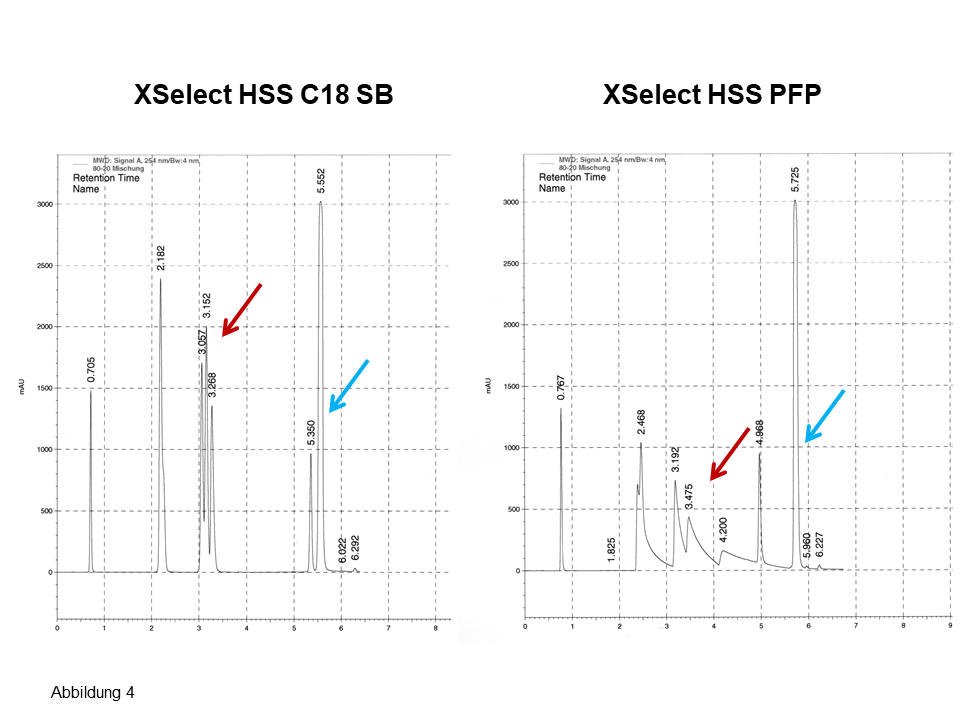
Abb. 4 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
Das Fazit
Für eine Vielzahl üblicher Trennprobleme sind moderne, endcappede Materialien zweifelsohne die richtige Wahl. Es gibt jedoch Fälle, in denen gerade Restsilanolgruppen eine Erhöhung der Selektivität bedingen. Das ist generell der Fall, wenn für die Selektivität zusätzliche Ionenaustausch-Wechselwirkungen notwendig sind wie beispielsweise bei Stellungsisomeren, Phospholipiden und starken Säuren/Basen. Eine evtl. suboptimale Peakform muss oft zu Gunsten einer guten polaren Selektivität in Kauf genommen werden. Es gilt folgende vereinfachte Regel: Je ähnlicher die Moleküle sind, umso notwendiger sind zusätzliche polare/ionische Wechselwirkungen für deren Trennung, umso langsamer die Kinetik bei der Desorption solcher Moleküle von der stationären Phase. Zur Auswahl und zum Vergleich von RP-Säulen siehe „Colona Vergleich und Auswahl von HPLC-RP-Säulen“ , ferner auch das Dokument „Einfache Tests zur Charakterisierung von HPLC-RP-Säulen“.

