Permanent auftretender Geisterpeak Faustregeln zu Log P und Log D Abnahme der Auflösung – eine mögliche Ursache Seit kurzem erscheint ein Geisterpeak bzw. stets ein Blindwert im Blank… Seit einiger Zeit taugt bei einer Methode – oder bei mehreren – die noch vor kurzem keine Probleme machte(n), ein Geisterpeak auf. Oder aber, Sie haben in Ihrem Blank auf einmal stets einen Blindwert. Und dieses Problem haben Sie unabhängig von der Anlage, dem/der Anwender(in) und sogar der Methode. D.h. das übliche Fehler-Ausschluss-Programm haben Sie gründlich aber leider erfolglos absolviert. Versuchen Sie in einem solchen Fall im Team sich zu erinnern,…
In diesem HPLC-Tipp geht es um diverse Probleme, die mit den Autosampler-Vials zu tun haben.
Vials, immer wieder vials…
- Beim Schütteln eines vials (bei mir leider immer wieder eine spontane Bewegung…) kann sich auf der Unterseite des vial-caps ein Substanzfilm bilden – die Reproduzierbarkeit der Injektion lässt zu wünschen übrig. Beim Vortexieren bzw. automatischen Schütteln ist diese Gefahr eher selten gegeben, die Präzision bei Wiederholinjektionen ist in der Regel besser
- Der Greifarm des Autosamplers hat evtl. ein vial verloren; wenn man Pech hat, versteckt sich jenes unter dem Karussell. Dadurch ist das Karussell nun etwas schief, die vials dort liegen ein wenig niedriger/höher, Ergebnis: Geänderte Peakflächen. Der Grund: Die Nadel stößt evtl. an den Wänden vom vial an oder sie kommt auf dem Boden auf. Oder aber im Falle von inhomogenen Probelösungen ergibt sich eine unterschiedliche Probekonzentration oder sogar ein Konzentrationsgradient . Und je nachdem, aus welcher Höhe die Nadel Probelösung ansaugt, ergeben sich Schwankungen der Peakfläche oder ein Trend dergleichen. Die Höhe eines vials kann sich auch dann verändern, wenn sich unter dem vial Schmutz, Dichtungsabrieb, Salzkriställchen usw. eingefunden haben
- Hellrote vs. dunkelrote vs. Silikon vs. vorgeschlitzte vs. „Sandwitch-Septen“; Unterschiede bezüglich Abriebs bzw. Verdampfens von Probelösungsmittel bzw. Neigung zu Memoryeffekt
- Vial richtig dicht vs. einfach „klack“ und somit eher locker aufgesetzt: Im ersten Fall ist die erste Injektion evtl. fehlerbehaftet (durch den Unterdruck beim erstmaligen Stechen der Nadel drückt sich etwas von der Probelösung in die Nadel hoch) im zweiten Fall sind alle Injektionen OK – auch die erste
- Vial, beispielsweise Nr. 18, geht immer wieder kaputt; das ist zwar ein seltener Fall, dennoch möchte ich ihn erwähnen: Durch einen Fabrikationsfehler kann beim 6-Port-Ventil passieren, dass die zwei Scheiben nicht 100% übereinander liegen. Bei wiederholten Problemen mit Injektionen nur aus einem bestimmten vial am besten zeitnah den Hersteller wegen eines Austausches kontaktieren
- Probleme beim Methodentransfer
Beim Methodentransfer tauchen oft deswegen Probleme auf, weil nicht alle Informationen ausgetauscht bzw. Begriffe unterschiedlich verstanden werden. Nachfolgend drei Beispiele betreffend die vials:
- „Wir arbeiten bei diesen geringen Volumina mit Aufsätzen, die sollt ihr auch verwenden“. „OK“. Nur: In einem Labor werden die beweglichen (und billigen) Aufsätze verwendet, im anderen die festen Aufsätze. Es ergeben sich womöglich unterschiedliche Peakflächen, weil im ersten Fall die Nadel links oder rechts die Vial-Wand berühren kann…
- „Wirkstoff X bleibt gerne hängen, ihr sollt vials mit inerter Oberfläche verwenden.“ „OK“. Nur: Versteht jede(r) unter „inert“ das Gleiche?
- Es werden statt Glas, PP-vials verwendet; die einen haben die normalen Eppi´s die anderen die low-bind Eppi´s …
- Die vials werden mit HCL behandelt; die Silanolgruppen auf der Glasoberfläche liegen undissoziiert vor, basische Wirkstoffe werden zwar nicht adsorbiert, Wasserstoffbrückenbindungen wären jedoch möglich
- Es werden silanisierte vials verwendet; analog einer endcappeden C18-Phase werden nicht nur keine basische sondern überhaupt keine polare Komponenten adsorbiert
- Es werden silikonisierte vials verwendet; durch die Silikon-Schutzschicht wird nicht lediglich Adsorption sondern auch eine Benetzung der Oberfläche verhindert, die Probelösung perlt einfach ab
- „Wir arbeiten mit vials mit so ´ne Verjüngung, weißt Du? „Ja, wir auch!“ Nur: Erstens, können solche Aufsätze unterschiedliche Länge aufweisen. Und zweitens kann der Durchmesser am Ende der Verjüngung unterschiedlich groß sein. Dadurch kann durch die Oberflächenspannung genau dort ein Luftbläschen entstehen – und dies abhängig vom Probelösungsmittel! Ergebnis: Unterschiedliche Peakflächen
In Abbildung 1 werden Aufsätze der Firma VWR gezeigt, die die hier
erwähnten Unterschiede demonstrieren.

Abbildung 1: Aufsätze für HPLC-vials unterschiedlicher Länge und unterschiedlicher Verjüngung, Details, siehe Text
Der Fall Sie arbeiten in einem regulierten Bereich und sind an strenge Prüfvorschriften gebunden. In einer solchen lautet die Forderung: „Auflösung R größer 1,5“, aber gerade diesen Wert erreichen Sie aktuell nicht. Welche regel-konforme Handgriffe kämen in Frage? Die Lösung Was möglich ist, hängt letzten Endes davon ab, wie genau die Angaben in der betreffenden PV sind. Ist in der Tat restlos alles – von der Eluentenzusammensetzung bis zu den Einstellungen („Settings“) – vorgegeben, so können Sie de facto es nur mit einer neuen Säule versuchen. Ist die PV etwas „weicher“, d.h. es sind nur die wichtigsten Parameter wie Säule,…
Der Fall
In den letzten Jahren wurde eine Reihe moderner C18- sowie polarer RP-Phasen eingeführt. Da wären beispielhaft zu nennen: Chemisch geschützte („embedded“ phases), hydrophil endcappede sowie Mixed Mode Phasen und was die Matrix betrifft: Hybrid-, Core Shell- oder monolithische Phasen. Diese Materialien weisen vielfach Vorteile auf. Heißt es nun, dass bei der Entwicklung einer neuen Methode der Einsatz einer solchen modernen Phase die richtige Wahl wäre? Sollte man also nicht-endcappede Phasen als eine alte Technologie „ad acta“ legen?
Die Lösung
Nein. Für die Trennung von Substanzen mit ähnlicher Hydrophobie, aber mit Unterschieden in der Anordnung von Substituenten am Molekül oder von Doppelbindungen in einer Seitenkette (α, β-Isomerie, Stellungsisomerie) oder stark polare Komponenten sind Restsilanolgruppen für die Selektivität sehr wichtig. Dies wird an drei Beispielen demonstriert:
Beispiel 1: Trennung von Steroiden
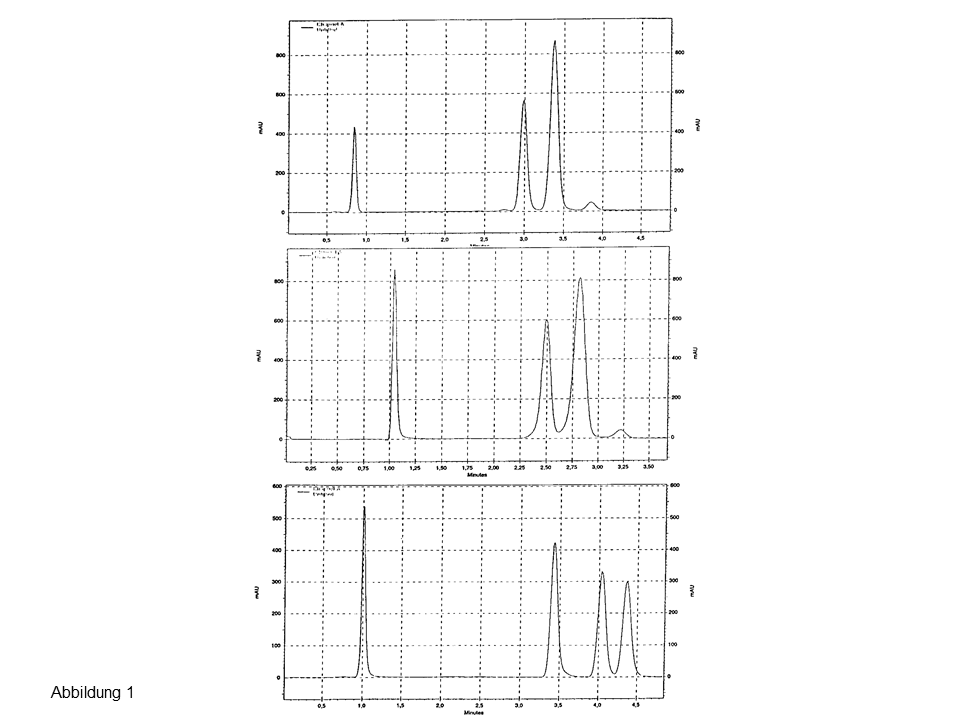
Abb. 1: Trennung von drei Steroiden an zwei endcappeden (oben, Mitte) und an einer nicht endcappeden C18-Phase (unten), Erläuterungen siehe Text.
Das obere und mittlere Chromatogramm zeigen die Injektion von drei Steroiden (α, β-Isomere) an zwei modernen, hydrophoben Phasen. Steroid Nr. 2 und 3 koeluieren. Die Trennung gelingt an Resolve C18, einem älteren, nicht endcappeden Material, siehe unteres Chromatogramm in Abbildung 1.
Beispiel 2: Trennung von starken Basen
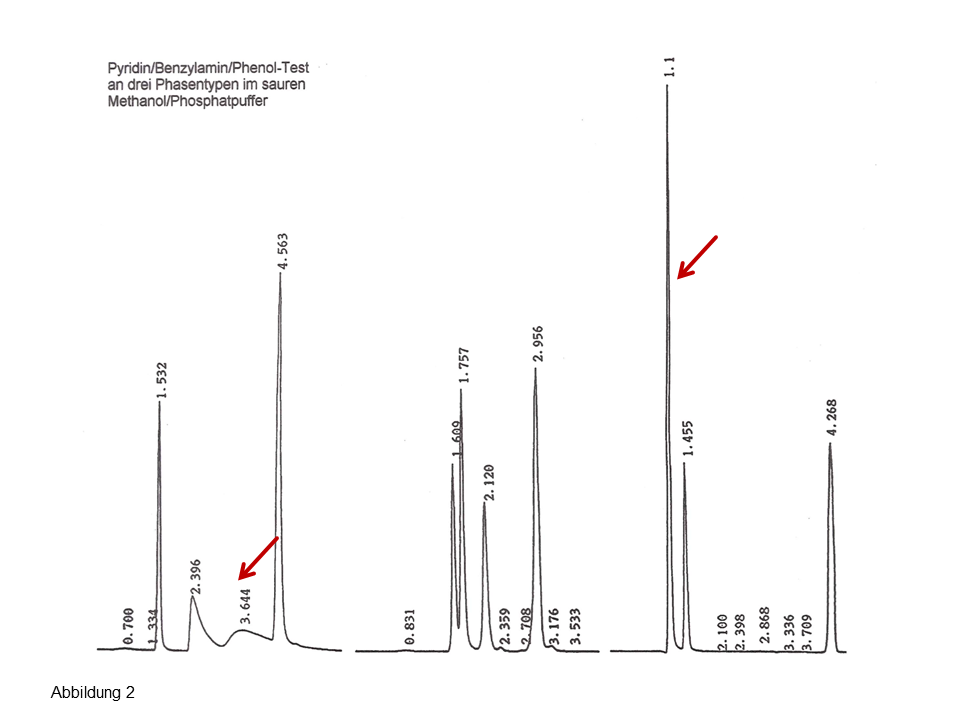
Abb. 2: Injektion einer Mischung von drei polaren Komponenten auf eine silanophile (links) und eine hydrophobe, endcappede C18-Phase (rechts), Erläuterungen, siehe Text.
Auf der rechten Seite der Abbildung 2 wird die Injektion von Uracil (inerte Komponente), Pyridin, Benzylamin und Phenol an einer modernen endcappeden C18-Säule gezeigt. Die zwei Basen koeluieren (erster Peak), was vollkommen nachvollziehbar ist: Man kann nicht erwarten, dass eine hydrophobe, gründlich endcappede Phase eine gute polare Selektivität aufweist. Und das kann zu falschen Schlussfolgerungen führen: Eine gute Peaksymmetrie suggeriert im Routinealltag eine gute Selektivität… Das linke Chromatogramm zeigt die Injektion auf eine „alte“, stark silanophile Phase, Hypersil ODS, das Ergebnis lautet: Eine hervorragende Selektivität für die zwei starke Basen bei gleichzeitig sehr langsamen Kinetik (starkes Tailing). Dass weitere polare Phasen wie beispielsweise eine C7-fluorierte Phase eine ebenso gute Selektivität aufweist (siehe mittleres Chromatogramm) versteht sich von selbst.
Beispiel 3: Injektion einer Mischung diverser Komponenten inkl. drei Isomeren (o-, m-, p-Toluidin)
An mehreren Säulen von Waters erhält man nahezu das gleiche Bild, die Chromatogramme sehen recht ähnlich aus, für die drei Isomere ergeben sich zwei Peaks, siehe Pfeile in Abbildung 3. Erst beim Einsetzen einer nicht-endcappeden Phase (Abbildung 4) sind für die drei Isomere drei Peaks zu sehen. Ferner: Betrachte bei den letzten zwei Peaks die Elutionsumkehr. Auch hier: Eine fluorierte Phase (Abbildung 4, rechts) zeigt eine noch bessere polare Selektivität bei einer noch langsameren Kinetik, siehe dazu das auffallend starke Tailing.
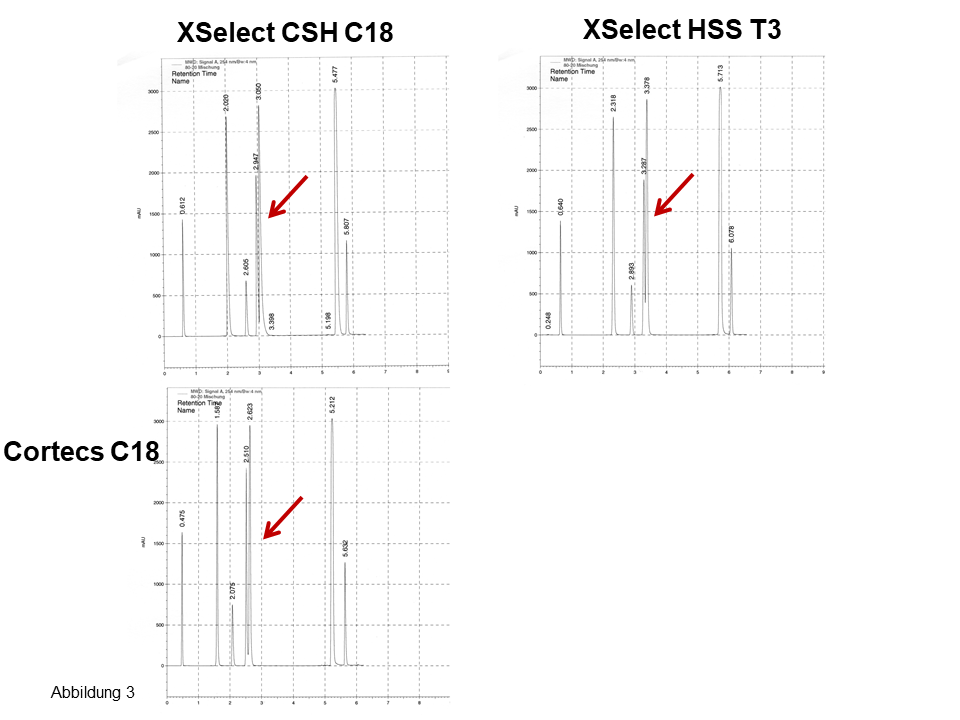
Abb. 3 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
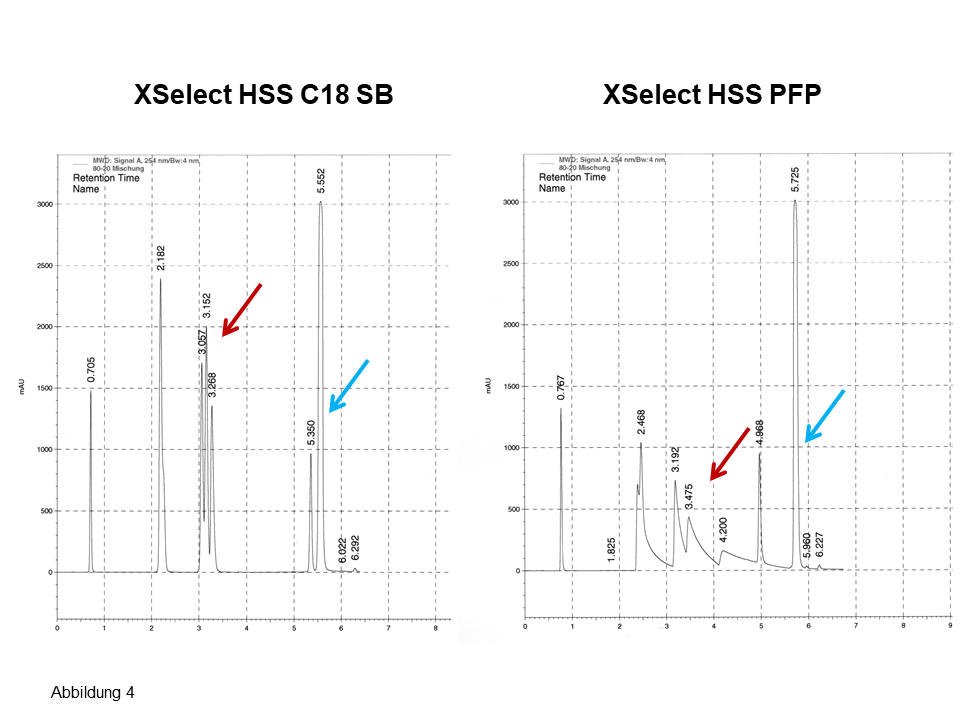
Abb. 4 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
Das Fazit
Für eine Vielzahl üblicher Trennprobleme sind moderne, endcappede Materialien zweifelsohne die richtige Wahl. Es gibt jedoch Fälle, in denen gerade Restsilanolgruppen eine Erhöhung der Selektivität bedingen. Das ist generell der Fall, wenn für die Selektivität zusätzliche Ionenaustausch-Wechselwirkungen notwendig sind wie beispielsweise bei Stellungsisomeren, Phospholipiden und starken Säuren/Basen. Eine evtl. suboptimale Peakform muss oft zu Gunsten einer guten polaren Selektivität in Kauf genommen werden. Es gilt folgende vereinfachte Regel: Je ähnlicher die Moleküle sind, umso notwendiger sind zusätzliche polare/ionische Wechselwirkungen für deren Trennung, umso langsamer die Kinetik bei der Desorption solcher Moleküle von der stationären Phase. Zur Auswahl und zum Vergleich von RP-Säulen siehe „Colona Vergleich und Auswahl von HPLC-RP-Säulen“ , ferner auch das Dokument „Einfache Tests zur Charakterisierung von HPLC-RP-Säulen“.
Der Fall In diesem HPLC-Tipp haben wir uns über folgenden Tatbestand unterhalten: Wenn ich in der HPLC einen physikalischen Parameter verändere, ist das Ergebnis selten eindeutig „gut“ oder „schlecht“. Je nach Betrachtungsweise bzw. Anforderungen überwiegen Vor- oder eben Nachteile. Dies gilt analog auch für chemische Parameter. Hier wollen wir stellvertretend sechs solcher betrachten, siehe Tabelle 1. Die Lösung Was Nachteile Vorteile Erhöhung der Temperatur In der Regel Abnahme der Selektivität und der Lebensdauer der Säule, ferner erhöhte Gefahr für Zersetzung von thermolabiler Analyten Abnahme der Retentionszeit und des Druckes, Verbesserung der Peakform und dadurch Zunahme der Peakkapazität (Anzahl der…
Der Fall Additiva (Modifier) oder einfache Zusätze wie Salze in der mobilen Phase können die Trennung positiv beeinflussen, ihr Einsatz bewährt sich seit Jahrzehnten. So kann beispielsweise die Peaksymmetrie und dadurch indirekt die Empfindlichkeit durch Verwendung von etwa Di- oder Triethylamin, DEA/TEA, Di-Tri- oder Fluoressigsäure, DFA/TFA/FA, Ionenpaarreagenzien wie Heptan- oder Oktansulfonsäure erhöht werden. Das Problem dabei: Solche Additiva werden teilweise an der Oberfläche der stationären Phase (irreversibel) adsorbiert, was in der Routine vielleicht ein geringe(re)s Problem darstellt. In der Methodenentwicklung jedoch ist dies störend, weil ja nach jedem Experiment die Säule mühsam durch Spülen wieder in den ursprünglichen Zustand gebracht…
- Optimale Zeitpunkt für die Elution der wichtigsten/kritischen Peaks
- Lagerung in MeOH/ACN
- Isokratische Stufe beim Gradienten im Fall von kurzen Säulen
„Optimale“ Elution – wann sollen meine wichtigsten Peaks eluieren?
Zunächst direkt die Aussage: Die optimale Elution für die interessierenden Peaks liegt nach ca. der drei bis fünffachen Totzeit („Front“, Injektionspeak). Sehen Sie zu, dass – wenn irgendwie möglich – wichtige/kritische Peaks bei einem Retentionsfaktor, k (k: Maß für die Stärke der Wechselwirkungen), von etwa drei bis fünf eluieren, d.h. eben nach der drei bis fünffachen Totzeit. Warum? Hier drei Gründe:
1. Ab hier etwa fängt der robuste Bereich an. Die Konsequenz: Konstante Retentionszeiten in der Routine; kleine ungewollte Veränderungen beim Eluenten oder bei der Temperatur wirken sich kaum aus
2. Dieser Bereich entspricht einem optimalen Bereich der Wechselwirkungen. Die Konsequenz: Optimaler Beitrag von k sorgt für eine gute Auflösung
3. In diesem Bereich ergibt sich eine gute Effizienz (gute Bodenzahl). Die Konsequenz: Keine übermäßige und damit störende Peakverbreiterung
In Methanol/Wasser gelagerte Säulen
Für längere Zeiträume (mehrere Wochen/Monate) eignen sich zur Lagerung von polaren RP-Phasen eher ACN/H2O- (mehr als ca. 60 % ACN) als MeOH/H2O-Gemische. Begründung: In einem ACN/H2O-Gemisch ist die Gefahr der Abspaltung durch Hydrolyse von kleinen, polaren funktionellen Gruppen, z. B. C8, C4, Diol, CN, PFP, Phenyl-Hexyl usw. – also das bekannte „Bluten“ der Säule – nahezu unerheblich. 100% Methanol dürfte dagegen unkritisch sein. Soweit, so gut. Nun, einige Hersteller liefern ihre Säulen in MeOH/H2O. Was kann jetzt passieren? Sie arbeiten mit einer recht polaren RP-Säule und die Trennung funktioniert bestens. Sie bestellen beim gleichen Hersteller erneut die gleiche Säule, mit dem Herstellerhinweis, dass es sich um die gleiche Charge wie bei der ersten Säule handelt, dennoch sieht Ihr Chromatogramm „scheußlich“ aus. Es mag sein, dass es sich um die gleiche Säulen-Charge handelt. Die zweite jedoch war beim Hersteller eventuell längere Zeit gelagert. Ein Teil der polaren funktionellen Gruppen, siehe weiter oben, ist womöglich abgespalten und man erhält im Fall von basischen Komponenten beispielsweise stark tailende Peaks, denn: Jene interagieren nun mit frei gewordenen aktiven Silanolgruppen.
„Gleiche“ Charge ist nicht für jeden dasselbe…
Es ist zweifelsohne sinnvoll, im Rahmen der Methodenentwicklung oder später bei der Validierung drei Säulenchargen auszutesten. Hier ist Vorsicht geboten: Wenn Sie beim Hersteller drei Säulen aus drei „verschiedenen Chargen“ bestellen, bekommen Sie meist tatsächlich drei Säulen aus drei unterschiedlichen Herstellungsschargen. Für manchen Hersteller jedoch bedeutet „unterschiedliche Chargen“, dass die Säulen zu unterschiedlichen Zeitpunkten gepackt worden sind, sie sind jedoch aus der gleichen Herstellungscharge…
Denke an MeOH bzw. MeOH/ACN-Gemische
Wasser aus dem Eluenten wird an der Oberfläche von polaren, stationären Phasen adsorbiert. Bei der Trennung von polaren Komponenten wirkt sich dies positiv aus. Als organisches Lösungsmittel eignet sich bei Trennungen von polaren Komponenten tendenziell eher Methanol als Acetonitril. Erwarten Sie nicht ausschließlich stark polare Komponenten sondern auch moderat-polare und evtl. auch neutrale (apolare) Komponenten? Für diesen Fall folgender Vorschlag: Wenn Sie Ihren Gradienten beispielsweise mit 20% B starten und auf 80% B hochfahren möchten, könnten Sie mit 10% MeOH/10% ACN starten und dann auf 40% MeOH/40% ACN hochfahren: Sie nutzen in diesem Fall die gute polare Selektivität durch das Methanol und die gute Peakform durch das ACN (geringe Viskosiität, scharfe Peaks). Generell gilt: Eine ternäre Mischung, also Wasser bzw. Puffer-ACN-MeOH, erweist sich bei einer großen Polaritäts-Bandbreite der Komponenten in der Probe oft als vorteilhaft. Dies gilt auch und gerade bei isokratischen Trennungen.
Großes Verweilvolumen und kleines Säulenvolumen…
Ein großes Verweilvolumen („Dwell“- oder „Delay-Volume“) bei einer Gradientenanlage bedeutet, dass zu Beginn des Gradienten eine isokratische Stufe vorgeschaltet ist. Eine solche mag mitunter etwas Positives bewirken: Manche Peaks am Chromatogramm-Anfang werden besser abgetrennt, als wenn der Gradient „sofort“ an der Säule wäre und dort direkt wirkte. Bei einer kurzen Säule jedoch „sieht“ der Gradient im Fall eines längeren isokratischen Schrittes am Anfang nur einen Teil der Säule, d.h. es werden im schlimmsten Fall nur 50% der Säulenlänge ausgenutzt. Die Peaks werden nach hinten „gestaucht“, bei mehr als 10-15 Peaks werden die letzten Peaks evtl. schlecht abgetrennt.
Zur Qualität von Lösungsmitteln für die HPLC – wann, was? Sowohl „Gradient grade“ als auch „LC-MS grade“ sind sehr reine Lösungsmittel – worin liegt nun der Unterschied? Wie die Bezeichnung es ahnen lässt: Gradient grade Lösungsmittel sind speziell für die spektroskopischen Detektoren (Fluoreszenz- und vor allem UV-Detektor) optimiert, sie sind frei von organischen Verunreinigungen. Das Ziel dabei ist es, dass insbesondere bei Gradientenmethoden gegen Ende des Gradientenlaufs keine Geisterpeaks auftauchen. LC-MS grade ist frei von ionischen Verunreinigungen, da ja jene ein verstärktes Rauschen verursachen würden. Ferner würde ihre Ionisierung zum Empfindlichkeitsverlust führen. Organische Verunreinigungen können hier zwar zugegen sein, die…

