Zusammenfassung Multidetektion und insbesondere 2D-Chromatographie sind die besten Tools, um Peakhomogenitäten zu überprüfen bzw. mittels letzterer die Auflösung zu verbessern. Der Aufwand jedoch bei der Etablierung einer 2D-HPLC sollte nicht unterschätzt werden. Ferner sind zwei Nachteile bei 2D-Anwendungen zu nennen: Mangelnde Robustheit und Verlust an Empfindlichkeit. Der Fall Beim letzten HPLC-Tipp haben wir uns den orthogonalen Test angeschaut: Eine gänzlich andere Säule und/oder ein gänzlich anderer Eluent sind sehr hilfreich, um die Peakhomogenität (Peakreinheit) zu überprüfen. Heute geht es um die in diesem Zusammenhang vermutlich zwei besten Tools: Stufe 1, recht einfach: Einsatz eines zweiten/dritten Detektors; Multidetektion ist mittlerweile in vielen Laboren eine Selbstverständlichkeit Stufe 2, recht aufwendig: „2D“ (2-dimensionale Chromatographie) anwenden; 3D gibt es zwar auch schon seit jeher – aber lassen wir es hier lieber … Was hat denn beides auf sich? Die Lösung Multidetektion Ein zweiter/dritter Detektor in Serie kann erstens Peaks detektieren, die bei Verwendung nur eines Detektors unsichtbar bleiben und zweitens Peaks, die schlecht abgetrennt sind, wenigstens als solche erkennen. In Abb. 1 wird die Verunreinigung bei 6,72 min nur mit MS (ESI-Positiv), jedoch nicht mit DAD erkannt (oberes Bild). Im ESI-Negativ-Modus (unteres Bild) ist zwar das Signal bei 6,72 min wesentlich größer, dafür fehlt…
Zusammenfassung: Orthogonaler Text: Verwende eine „ganz“ andere Säule (z. B. statt einer C18 nun eine PFP oder eine Mixed Mode) und/oder einen anderen Eluenten (mobile Phase statt mit ACN nun mit MeOH) und injiziere erneut. Ähnliche Substanzen gehen wahrscheinlich (etwas) andere Wechselwirkungen mit der stationären Phase ein. Somit offenbart sich, dass ein symmetrischer Peak evtl. doch nicht homogen ist. Der Fall In den letzten zwei HPLC-Tipps haben wir folgendes gesehen: Eine Änderung von Einstellparametern („Settings“) sowie „Manipulationen“ der Probelösung stellen schnelle Möglichkeiten dar, die Peakhomogenität zu prüfen. Heute geht es um den orthogonalen Test. Was ist das und was „bringt“ er? Die Lösung Am Ende einer Methodenentwicklung kommt häufig die Frage auf: „Habe ich alle Peaks trennen können, oder liegt womöglich irgendwo im Chromatogramm doch eine Koelution vor“? Jetzt kommt der orthogonale Test ins Spiel – die Idee dahinter: Man verwende eine völlig andere stationäre Phase oder einen anderen Eluenten und injiziert erneut. Es ist ziemlich unwahrscheinlich, dass zwei oder drei Komponenten bei Verwendung zweier gänzlich (!) unterschiedlichen Säulen bzw. Eluenten in beiden Fällen völlig gleich starke Wechselwirkungen mit der stationären Phase eingehen. Wenn nun mit einem Eluenten an zwei unterschiedlichen Säulen oder mit zwei unterschiedlichen Eluenten an einer Säule…
Der Fall Im HPLC-Tipp vom letzten Dezember war Peaky am Zweifeln, ob er es wirklich ist: „Bin ich überhaupt der Peaky? Und wenn ja, wieso fühlt es sich so an, als wäre ich mehrere …“ Es geht also um die Frage, ob ein Peak homogen ist oder womöglich doch eine Koelution vorliegt. Im vorliegenden HPLC-Tipp werden wir uns einfache Tests anschauen, die recht schnell durchzuführen sind: Keine Änderung der chromatographischen Parameter, keine Änderung der Apparatur. In den nächsten HPLC-Tipps werden wir uns sukzessiv mit aufwendigeren Methoden beschäftigen. Die Lösung Eine Veränderung von Einstellparameter („Settings“) kann helfen, innerhalb von Sekunden/Minuten die Peakhomogenität zu überprüfen. Es lohnt sich (auch) an solche „banale“, schnelle Möglichkeiten zu denken: Injektion bei einer anderen (niedrigeren) Wellenlänge, siehe Abbildung 1: Bei 271 nm erscheint der dritte Peak als ein Peak (unteres Chromatogramm), bei 225 nm sind zwei Peaks zu erkennen (oberes Chromatogramm) 2. Eine große Zeitkonstante („Filter Response“, „Filter Time Constant“) führt zwar zu einer ruhigeren Basislinie, die Peakbreite nimmt allerdings zu, man verliert an Auflösung. Folgendes Zahlenbeispiel aus einer „Technical Note“ von Waters, die freundlicherweise von Sascha Schifrin zur Verfügung gestellt wurde: Kein digitales Filtern: Auflösung (Resolution) 3,16, Peakkapazität 16 Zeitkonstante, 0,5 Min: Auflösung 1,82,…
Der Fall Nehmen wir an, Sie haben recht viele, recht ähnliche Komponenten zu trennen. In einem solchen Fall ist eine ausreichende Selektivität – also unterschiedlich starke Wechselwirkungen der einzelnen Komponenten mit der stationären Phase – realistischerweise kaum erreichbar. Der einzige Ausweg lautet: Eine möglichst gute Peakkapazität, also maximal mögliche Anzahl Peaks pro Zeiteinheit. Wie ist dies zu erzielen? Die Lösung Es gibt mehrere Formeln für die Peakkapazität, die zwei einfachsten sind folgende: nC = tRl – tRf / w und nC = tG / w mit: nC: Peakkapazität tRl: Retentionszeit des letzten Peaks tRf: Retentionszeit des ersten Peaks tG: Gradientendauer w: Peakbreite Was heißt das nun? Vereinfacht folgendes: Ich brauche eine große Differenz zwischen der Retentionszeit des letzten und des ersten Peaks und die Peakbreite soll möglichst klein sein. Diese allgemeine Forderung ist „zeitlos“, gilt für alle Gradientenarten und ist auch unabhängig davon, ob es sich um kleine oder große (Bio)Moleküle handelt. D. h. sie ist anwendbar sowohl imfalle von RP-Trennungen als auch beispielsweise bei Ionenaustauschertrennungen von Oligonucleotiden mittels Salz- bzw. pH-Wert-Gradienten. Was braucht man also? * Einen langen Gradienten und einen hohen Fluss (großes Gradientenvolumen) * Eine lange, möglichst dünne Säule (große Retentionszeitdifferenz letzter/ertster Peak, maximal erreichbare Auflösung aufgrund…
Liebe Leserinnen, liebe Leser, weiter unten finden Sie den jeweils ersten Teil der halben Sätze aus dem Dezember-Tipp, so dass nun die Befunde komplett sind: Ich weiß, dass … … sich der Fluss geändert hat (Leck, Luft in der Pumpe)… weil die Peakfläche, aber kaum die Peakhöhe sich geändert hat … das Probelösungsmittel organischer ist als der Eluent/der Anfangsgradient… weil die frühen Peaks mit einem starken Fronting eluieren … der pH-Wert des Eluenten sich geändert hat oder – seltener – funktionelle Gruppen auf der stationären Phase hydrolysiert worden und dadurch nun mehr Silanolgruppen vorhanden sind … weil nur einige Peaks tailen und auch später eluieren – restliche Peaks sind OK … dass ich eine recht hydrophobe, endcappte, „klassische“ C18 stationäre Phase habe… weil eine derartige RP-Phase sehr ähnliche Komponenten (z. B. Isomere) nicht trennen kann … dass ich in der Probe entweder sehr große Moleküle oder sehr kleine, ionisch vorliegende Substanzen habe… weil solche Komponenten vor der Totzeit eluieren (Peaks vom letzten Lauf, Kontaminationen im Eluenten, Luft usw. können ausgeschlossen werden) … dass das Totvolumen der Apparatur zu groß im Vergleich zu dem Säulenvolumen ist…weil dies die einzige Ursache sein kann, dass bei neutralen Komponenten die Peaksymmetrie mit zunehmender Retention…
Trends in der HPLC Stavros Kromidas Vom 18.-22. Juni 2023 fand in Düsseldorf die HPLC2023 („International Symposium on High Performance Liquid Phase Separations and Related Techniques”), die wichtigste und größte Tagung auf dem Gebiet der HPLC, statt. Nachfolgend erfolgt ein kurzer Bericht über Trends und Highlights. Vorab jedoch ein Punkt, den ich mir selbst immer wieder bewusst machen muss: Auf solchen Tagungen werden naturgemäß zum großen Teil Ergebnisse und Projekte aus der Forschung vorgestellt. Dieses Bild der HPLC entspricht selbstverständlich nicht der Ist-Situation in „real-life“ Labors. Ob und wann besprochene Techniken das „normale“ HPLC-Labor auf breiter Basis erreichen, ist ungewiss. Highlight: Mehrdimensionale Trennungen Kaum ein Vortrag, ein Tutorial oder ein Poster in dem es nicht um „Multi“ ging: Im einfachsten Fall um Multidetektion, multimodale MS, 3-4 D-Chromatographie usw., also kurzum: Mehrdimensionale Kopplungstechniken. Begründung: Die Herausforderung in aktuell wichtigen Gebieten wie „omics“ (Metabolomics, Lipidomics, Proteomics, Metallomics), Forensik, Umweltanalytik, Spezialpolymeren, personalisierte Medizin etc. lautet: Erfassung von Metaboliten, Verunreinigungen, Zersetzungsprodukten, das sind beispielsweise vielfach Isobare/Isomere – und: Neben der „Trennung“ geht es um möglichst genaue Strukturinformationen, im optimalen Fall um evidenzbasierte Identifizierung. Und dies noch in einer unwahrscheinlich großen und unbekannten Zahl zudem in äußerst geringen Konzentrationen. Schließlich heißt das Ziel: Maximale Information…
Geisterpeaks – aber erst „später“ Verbesserung der Empfindlichkeit Geisterpeaks, die „später“ oder erst in einigen Tagen erscheinen Geisterpeaks erscheinen meist plötzlich. Man wundert sich wieso, hat man doch an den chromatographischen Bedingungen nichts geändert. Nun, es sind schon einige Situationen denkbar, in denen Geisterpeaks erst nach einer gewissen Zeit zu sehen sind. Nachfolgend einige Beispiele dazu (zur Problematik von Geisterpeaks ab und an siehe auch diesen Tipp): Katalytische Wirkung des Kieselgels Kieselgel ist ein guter Feststoffkatalysator; bei längeren Läufen werden womöglich nur solche Substanzen verändert, die lange an der Oberfläche des Materials haften und somit…
Der Fall Sie arbeiten in einem regulierten Bereich und sind an strenge Prüfvorschriften gebunden. In einer solchen lautet die Forderung: „Auflösung R größer 1,5“, aber gerade diesen Wert erreichen Sie aktuell nicht. Welche regel-konforme Handgriffe kämen in Frage? Die Lösung Was möglich ist, hängt letzten Endes davon ab, wie genau die Angaben in der betreffenden PV sind. Ist in der Tat restlos alles – von der Eluentenzusammensetzung bis zu den Einstellungen („Settings“) – vorgegeben, so können Sie de facto es nur mit einer neuen Säule versuchen. Ist die PV etwas „weicher“, d.h. es sind nur die wichtigsten Parameter wie Säule,…
Der Fall
In den letzten Jahren wurde eine Reihe moderner C18- sowie polarer RP-Phasen eingeführt. Da wären beispielhaft zu nennen: Chemisch geschützte („embedded“ phases), hydrophil endcappede sowie Mixed Mode Phasen und was die Matrix betrifft: Hybrid-, Core Shell- oder monolithische Phasen. Diese Materialien weisen vielfach Vorteile auf. Heißt es nun, dass bei der Entwicklung einer neuen Methode der Einsatz einer solchen modernen Phase die richtige Wahl wäre? Sollte man also nicht-endcappede Phasen als eine alte Technologie „ad acta“ legen?
Die Lösung
Nein. Für die Trennung von Substanzen mit ähnlicher Hydrophobie, aber mit Unterschieden in der Anordnung von Substituenten am Molekül oder von Doppelbindungen in einer Seitenkette (α, β-Isomerie, Stellungsisomerie) oder stark polare Komponenten sind Restsilanolgruppen für die Selektivität sehr wichtig. Dies wird an drei Beispielen demonstriert:
Beispiel 1: Trennung von Steroiden
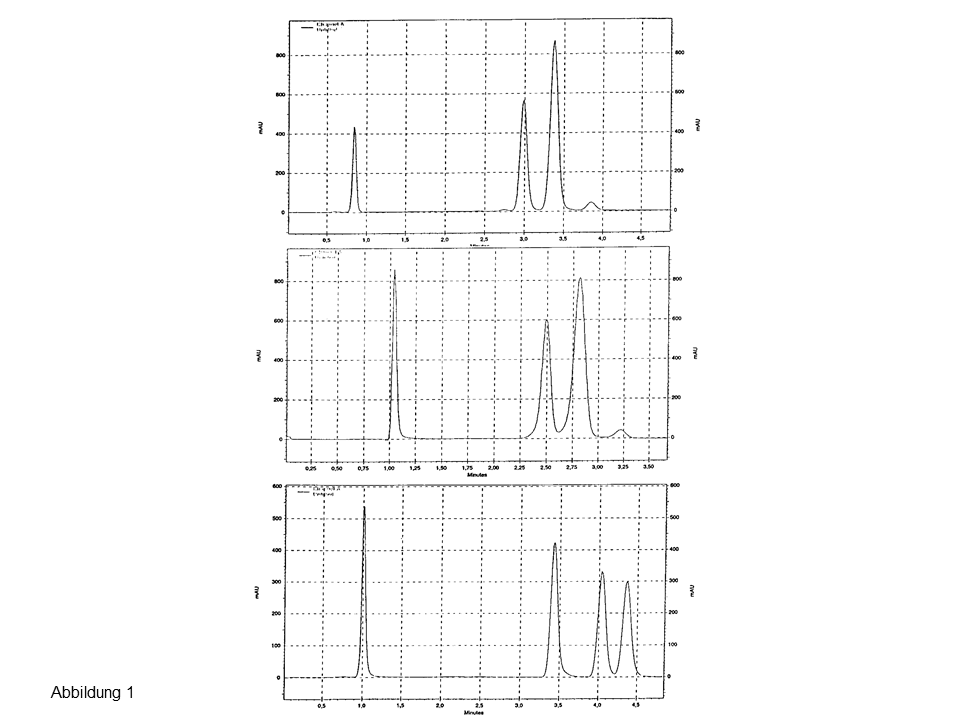
Abb. 1: Trennung von drei Steroiden an zwei endcappeden (oben, Mitte) und an einer nicht endcappeden C18-Phase (unten), Erläuterungen siehe Text.
Das obere und mittlere Chromatogramm zeigen die Injektion von drei Steroiden (α, β-Isomere) an zwei modernen, hydrophoben Phasen. Steroid Nr. 2 und 3 koeluieren. Die Trennung gelingt an Resolve C18, einem älteren, nicht endcappeden Material, siehe unteres Chromatogramm in Abbildung 1.
Beispiel 2: Trennung von starken Basen
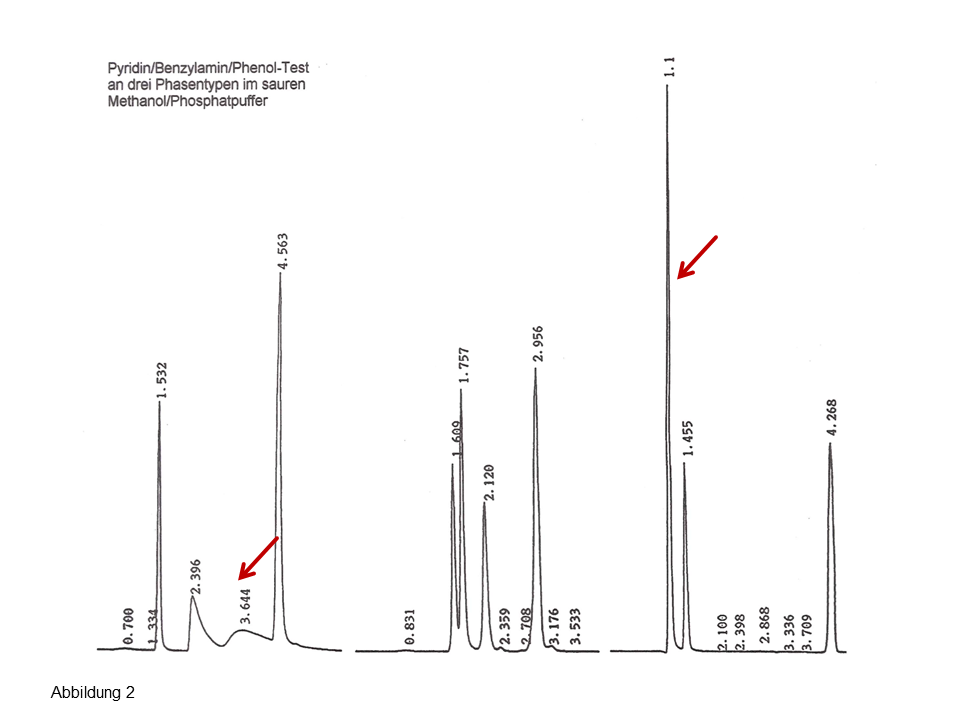
Abb. 2: Injektion einer Mischung von drei polaren Komponenten auf eine silanophile (links) und eine hydrophobe, endcappede C18-Phase (rechts), Erläuterungen, siehe Text.
Auf der rechten Seite der Abbildung 2 wird die Injektion von Uracil (inerte Komponente), Pyridin, Benzylamin und Phenol an einer modernen endcappeden C18-Säule gezeigt. Die zwei Basen koeluieren (erster Peak), was vollkommen nachvollziehbar ist: Man kann nicht erwarten, dass eine hydrophobe, gründlich endcappede Phase eine gute polare Selektivität aufweist. Und das kann zu falschen Schlussfolgerungen führen: Eine gute Peaksymmetrie suggeriert im Routinealltag eine gute Selektivität… Das linke Chromatogramm zeigt die Injektion auf eine „alte“, stark silanophile Phase, Hypersil ODS, das Ergebnis lautet: Eine hervorragende Selektivität für die zwei starke Basen bei gleichzeitig sehr langsamen Kinetik (starkes Tailing). Dass weitere polare Phasen wie beispielsweise eine C7-fluorierte Phase eine ebenso gute Selektivität aufweist (siehe mittleres Chromatogramm) versteht sich von selbst.
Beispiel 3: Injektion einer Mischung diverser Komponenten inkl. drei Isomeren (o-, m-, p-Toluidin)
An mehreren Säulen von Waters erhält man nahezu das gleiche Bild, die Chromatogramme sehen recht ähnlich aus, für die drei Isomere ergeben sich zwei Peaks, siehe Pfeile in Abbildung 3. Erst beim Einsetzen einer nicht-endcappeden Phase (Abbildung 4) sind für die drei Isomere drei Peaks zu sehen. Ferner: Betrachte bei den letzten zwei Peaks die Elutionsumkehr. Auch hier: Eine fluorierte Phase (Abbildung 4, rechts) zeigt eine noch bessere polare Selektivität bei einer noch langsameren Kinetik, siehe dazu das auffallend starke Tailing.
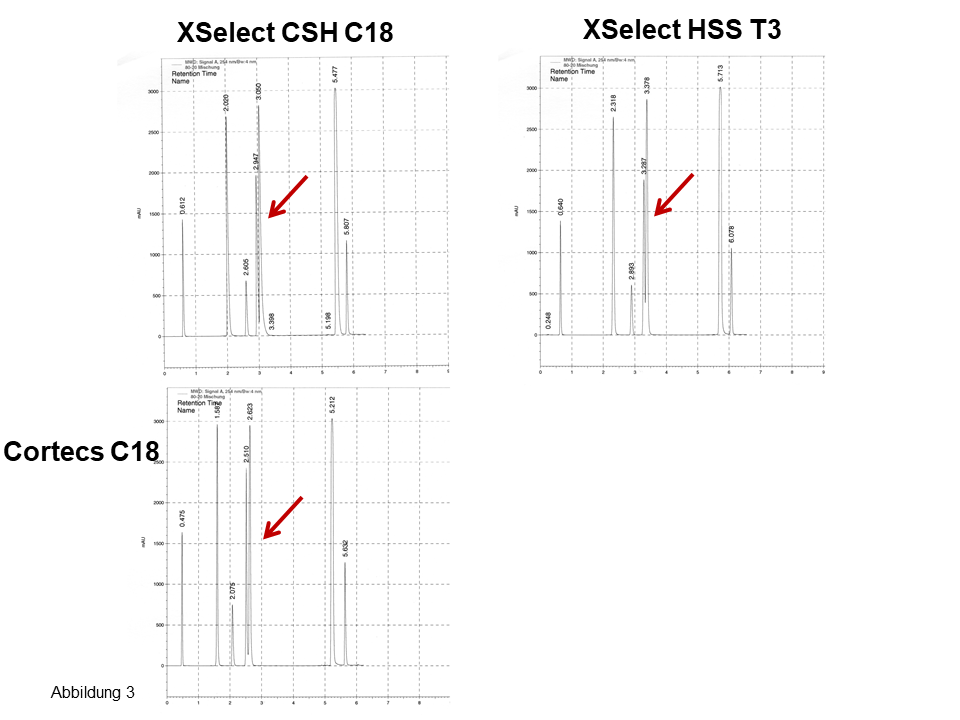
Abb. 3 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
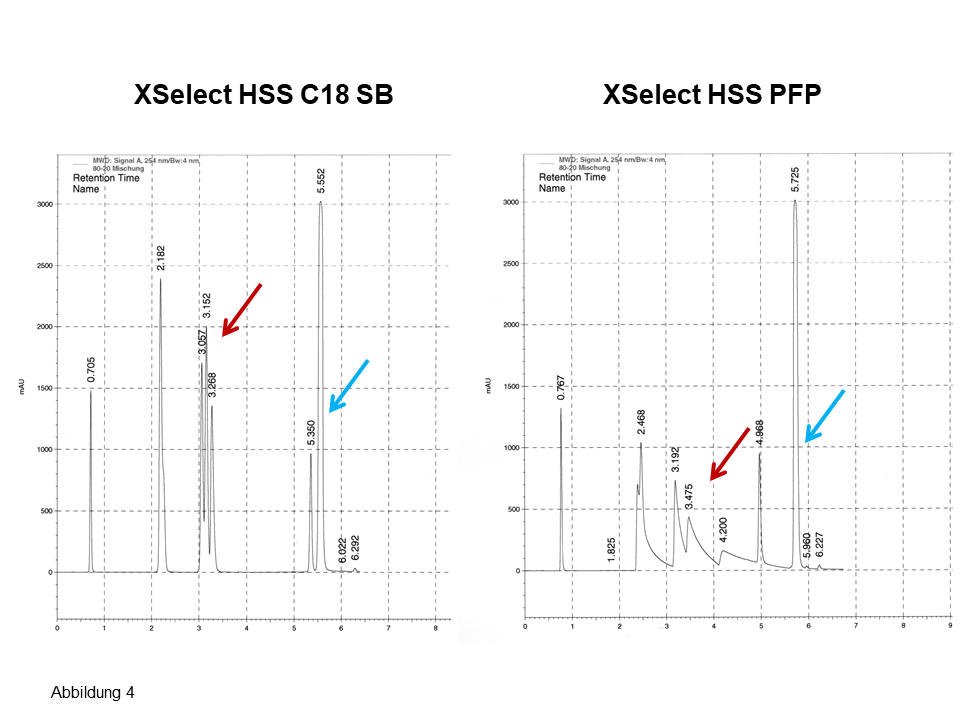
Abb. 4 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
Das Fazit
Für eine Vielzahl üblicher Trennprobleme sind moderne, endcappede Materialien zweifelsohne die richtige Wahl. Es gibt jedoch Fälle, in denen gerade Restsilanolgruppen eine Erhöhung der Selektivität bedingen. Das ist generell der Fall, wenn für die Selektivität zusätzliche Ionenaustausch-Wechselwirkungen notwendig sind wie beispielsweise bei Stellungsisomeren, Phospholipiden und starken Säuren/Basen. Eine evtl. suboptimale Peakform muss oft zu Gunsten einer guten polaren Selektivität in Kauf genommen werden. Es gilt folgende vereinfachte Regel: Je ähnlicher die Moleküle sind, umso notwendiger sind zusätzliche polare/ionische Wechselwirkungen für deren Trennung, umso langsamer die Kinetik bei der Desorption solcher Moleküle von der stationären Phase. Zur Auswahl und zum Vergleich von RP-Säulen siehe „Colona Vergleich und Auswahl von HPLC-RP-Säulen“ , ferner auch das Dokument „Einfache Tests zur Charakterisierung von HPLC-RP-Säulen“.
Der Fall In diesem HPLC-Tipp haben wir uns über folgenden Tatbestand unterhalten: Wenn ich in der HPLC einen physikalischen Parameter verändere, ist das Ergebnis selten eindeutig „gut“ oder „schlecht“. Je nach Betrachtungsweise bzw. Anforderungen überwiegen Vor- oder eben Nachteile. Dies gilt analog auch für chemische Parameter. Hier wollen wir stellvertretend sechs solcher betrachten, siehe Tabelle 1. Die Lösung Was Nachteile Vorteile Erhöhung der Temperatur In der Regel Abnahme der Selektivität und der Lebensdauer der Säule, ferner erhöhte Gefahr für Zersetzung von thermolabiler Analyten Abnahme der Retentionszeit und des Druckes, Verbesserung der Peakform und dadurch Zunahme der Peakkapazität (Anzahl der…

