Zusammenfassung Multidetektion und insbesondere 2D-Chromatographie sind die besten Tools, um Peakhomogenitäten zu überprüfen bzw. mittels letzterer die Auflösung zu verbessern. Der Aufwand jedoch bei der Etablierung einer 2D-HPLC sollte nicht unterschätzt werden. Ferner sind zwei Nachteile bei 2D-Anwendungen zu nennen: Mangelnde Robustheit und Verlust an Empfindlichkeit. Der Fall Beim letzten HPLC-Tipp haben wir uns den orthogonalen Test angeschaut: Eine gänzlich andere Säule und/oder ein gänzlich anderer Eluent sind sehr hilfreich, um die Peakhomogenität (Peakreinheit) zu überprüfen. Heute geht es um die in diesem Zusammenhang vermutlich zwei besten Tools: Stufe 1, recht einfach: Einsatz eines zweiten/dritten Detektors; Multidetektion ist mittlerweile in vielen Laboren eine Selbstverständlichkeit Stufe 2, recht aufwendig: „2D“ (2-dimensionale Chromatographie) anwenden; 3D gibt es zwar auch schon seit jeher – aber lassen wir es hier lieber … Was hat denn beides auf sich? Die Lösung Multidetektion Ein zweiter/dritter Detektor in Serie kann erstens Peaks detektieren, die bei Verwendung nur eines Detektors unsichtbar bleiben und zweitens Peaks, die schlecht abgetrennt sind, wenigstens als solche erkennen. In Abb. 1 wird die Verunreinigung bei 6,72 min nur mit MS (ESI-Positiv), jedoch nicht mit DAD erkannt (oberes Bild). Im ESI-Negativ-Modus (unteres Bild) ist zwar das Signal bei 6,72 min wesentlich größer, dafür fehlt…
Der Fall Wie beim vorherigen HPLC-Tipp geht es auch heute um die Frage, ob ein Peak homogen ist oder womöglich doch eine Koelution vorliegt. Beim letzten Mal haben wir gesehen, dass eine Änderung der Einstellparameter („Settings“) durchaus hilfreich sein kann. Heute steht die Probelösung im Focus: Schnell durchzuführende „Manipulationen“ bzgl. Probelösung können ebenso helfen. Welche wären das? Die Lösung Verdünne die Probelösung oder injiziere weniger Wir alle überladen öfters als gedacht die „arme“ Säule. Ergebnis: Verschlechterung der Auflösung. Eine lokale Überladung der Säule macht sich vor allem am Anfang des Chromatogramms bemerkbar; dort eluieren in einem RP-System polare Komponenten, die zusätzliche polare Wechselwirkungen mit der Oberfläche der stationären Phase eingehen können („Dualer Mechanismus“). Die Devise lautet: Probelösung, also Diluent, einfach mit Wasser verdünnen oder vielleicht noch einfacher: Weniger injizieren. In Abbildung 1, rechts, wird die Injektion von 20 µl Acetophenon gezeigt: Der erste Peak ist eine Verunreinigung, der zweite die Hauptkomponente Acetophenon. Anschließend wurde lediglich Eluent injiziert, linkes Chromatogramm. D.h. hier wurde der Memory-Effekt ausgenutzt: Es befindet sich häufig ein kleiner Rest der Probe an der Nadel, der nicht immer 100% weggespült wird. Wie man leicht erkennt, ist die Verunreinigung sauber, Acetophenon dagegen nicht: Auch mit 20 µl kann eine…
Der Fall Im HPLC-Tipp vom letzten Dezember war Peaky am Zweifeln, ob er es wirklich ist: „Bin ich überhaupt der Peaky? Und wenn ja, wieso fühlt es sich so an, als wäre ich mehrere …“ Es geht also um die Frage, ob ein Peak homogen ist oder womöglich doch eine Koelution vorliegt. Im vorliegenden HPLC-Tipp werden wir uns einfache Tests anschauen, die recht schnell durchzuführen sind: Keine Änderung der chromatographischen Parameter, keine Änderung der Apparatur. In den nächsten HPLC-Tipps werden wir uns sukzessiv mit aufwendigeren Methoden beschäftigen. Die Lösung Eine Veränderung von Einstellparameter („Settings“) kann helfen, innerhalb von Sekunden/Minuten die Peakhomogenität zu überprüfen. Es lohnt sich (auch) an solche „banale“, schnelle Möglichkeiten zu denken: Injektion bei einer anderen (niedrigeren) Wellenlänge, siehe Abbildung 1: Bei 271 nm erscheint der dritte Peak als ein Peak (unteres Chromatogramm), bei 225 nm sind zwei Peaks zu erkennen (oberes Chromatogramm) 2. Eine große Zeitkonstante („Filter Response“, „Filter Time Constant“) führt zwar zu einer ruhigeren Basislinie, die Peakbreite nimmt allerdings zu, man verliert an Auflösung. Folgendes Zahlenbeispiel aus einer „Technical Note“ von Waters, die freundlicherweise von Sascha Schifrin zur Verfügung gestellt wurde: Kein digitales Filtern: Auflösung (Resolution) 3,16, Peakkapazität 16 Zeitkonstante, 0,5 Min: Auflösung 1,82,…
Im – jedenfalls kalendarischen …– Sommer wollen wir uns mit kleinen, knackigen Tipps beschäftigen. Heuer geht es um „die 80 %-Regel“, „Vorteile von Methanol“ und „Mach´ Probelösung und Eluent möglichst ähnlich“. „80%-Regel“ Bei einer Routine-Methode steht i.d.R. Robustheit an erster Stelle, das heißt beispielsweise: Ich erwarte reproduzierbare Ergebnisse und die Säule soll möglichst lange halten. Es hat sich gezeigt, dass ein „Puffer“, also ein Abstand, von ca. 20 % von einem Grenzwert Sicherheit liefert. Nachfolgend einige Beispiele: Einige GPC/SEC-Säulen sind laut Datenblatt bis 100 bar stabil; das Nicht-Überschreiten von 80 bar im Dauerbetrieb beschert eine lange Lebensdauer Manch ‘ein Säulenofen ist von 5 – 80 °C spezifiziert; an beiden Grenzen – also ca. 6 °C sowie ca. 70 °C – ist eine richtige und präzise Temperatur-Einstellung nicht immer gewährleistet. Messungen in diesen Bereichen sind oft nicht reproduzierbar Bei einer Reihe von Säulen wird als pH-Wert-Verträglichkeit der Bereich 2 – 8 angegeben; im Dauerbetrieb würde ich allerdings bei derart spezifizierten stationären Phasen nicht unter ca. pH von 2,4 und nicht über ca. pH 6,5 gehen: Im Sauren können kleine funktionelle Gruppen hydrolysiert werden („Bluten“ der Säule) und ab ca. pH 7,0 kann sich das Kieselgel auflösen. Denke in diesem Zusammenhang auch…
Der Fall Nehmen wir an, Sie haben recht viele, recht ähnliche Komponenten zu trennen. In einem solchen Fall ist eine ausreichende Selektivität – also unterschiedlich starke Wechselwirkungen der einzelnen Komponenten mit der stationären Phase – realistischerweise kaum erreichbar. Der einzige Ausweg lautet: Eine möglichst gute Peakkapazität, also maximal mögliche Anzahl Peaks pro Zeiteinheit. Wie ist dies zu erzielen? Die Lösung Es gibt mehrere Formeln für die Peakkapazität, die zwei einfachsten sind folgende: nC = tRl – tRf / w und nC = tG / w mit: nC: Peakkapazität tRl: Retentionszeit des letzten Peaks tRf: Retentionszeit des ersten Peaks tG: Gradientendauer w: Peakbreite Was heißt das nun? Vereinfacht folgendes: Ich brauche eine große Differenz zwischen der Retentionszeit des letzten und des ersten Peaks und die Peakbreite soll möglichst klein sein. Diese allgemeine Forderung ist „zeitlos“, gilt für alle Gradientenarten und ist auch unabhängig davon, ob es sich um kleine oder große (Bio)Moleküle handelt. D. h. sie ist anwendbar sowohl imfalle von RP-Trennungen als auch beispielsweise bei Ionenaustauschertrennungen von Oligonucleotiden mittels Salz- bzw. pH-Wert-Gradienten. Was braucht man also? * Einen langen Gradienten und einen hohen Fluss (großes Gradientenvolumen) * Eine lange, möglichst dünne Säule (große Retentionszeitdifferenz letzter/ertster Peak, maximal erreichbare Auflösung aufgrund…
Liebe Leserinnen, liebe Leser, weiter unten finden Sie den jeweils ersten Teil der halben Sätze aus dem Dezember-Tipp, so dass nun die Befunde komplett sind: Ich weiß, dass … … sich der Fluss geändert hat (Leck, Luft in der Pumpe)… weil die Peakfläche, aber kaum die Peakhöhe sich geändert hat … das Probelösungsmittel organischer ist als der Eluent/der Anfangsgradient… weil die frühen Peaks mit einem starken Fronting eluieren … der pH-Wert des Eluenten sich geändert hat oder – seltener – funktionelle Gruppen auf der stationären Phase hydrolysiert worden und dadurch nun mehr Silanolgruppen vorhanden sind … weil nur einige Peaks tailen und auch später eluieren – restliche Peaks sind OK … dass ich eine recht hydrophobe, endcappte, „klassische“ C18 stationäre Phase habe… weil eine derartige RP-Phase sehr ähnliche Komponenten (z. B. Isomere) nicht trennen kann … dass ich in der Probe entweder sehr große Moleküle oder sehr kleine, ionisch vorliegende Substanzen habe… weil solche Komponenten vor der Totzeit eluieren (Peaks vom letzten Lauf, Kontaminationen im Eluenten, Luft usw. können ausgeschlossen werden) … dass das Totvolumen der Apparatur zu groß im Vergleich zu dem Säulenvolumen ist…weil dies die einzige Ursache sein kann, dass bei neutralen Komponenten die Peaksymmetrie mit zunehmender Retention…
1. „Schwach“ ist oft effektiver – im positiven oder im negativen Sinn 2. Auflösung bei einer RP-Trennung nicht vorhanden – effektive Maßnahmen „Schwach“ ist oft effektiver – im positiven oder im negativen Sinn An schwachen Ionenaustauscher (WCX) werden sehr ähnliche ionische Komponenten häufig besser getrennt als an starken (SCX) Mit einer schwachen Probelösung(im RP-Modus: Jene einfach mit Wasser verdünnen oder mit Neutralsalz versetzen) erreicht man häufig eine Verbesserung der Peakform und somit der Auflösung, vor allem bei früh eluierenden Peaks Analog die mobile Phase: Ein schwächerer Eluent (im RP-Modus: Wasser-/Pufferreich) führt in der Regel zu einer besseren Trennung Eine schwächere Isopropanol/Wasser-Lösung (z. B….
- Säurezusatz im Eluenten
- Gefahr für Niederschläge
- Vorsäule ja, aber was für eine?
Alternativen zu TFA
Trifluoressigsäure (TFA) wird gerne zum Ansäuern in der RP-HPLC verwendet, häufig bei – eventuell erst in der Zukunft geplanten – LC-MS-Kopplungen. TFA bereitet jedoch bekanntlich einige Probleme, so in etwa Basisliniendrift, immer wieder Empfindlichkeitsverlust, TFA kann lange auf der Säule bleiben usw. Welche Alternativen hätten wir? Wenn Ameisensäure für bestimmte Trennungen nicht sauer genug ist, könnte man an Pikrin- oder an Sulfamin- oder an Difluoressigsäure (DFA) denken. Ferner – sollte ein Ionenpaarreagenz benötigt werden – an Methansulfonsäure. Noch ein Wort zu Phosphatpuffer: Phosphorsäure bzw. ein Phosphatpuffer bewährt sich seit langem in der RP-HPLC mit UV-Detektion. Sollten Sie mit der Trennung bzgl. Selektivität/Peakform bei Anwendung von Phosphorsäure oder Phosphatpuffer zufrieden sein, könnte man getrost eine LC-MS-Trennung wagen: Bei einer Verwendung von ca. 10 mM Phosphatpuffer müsste man erst nach 4-5 Stunden das Interface reinigen. Merke in diesem Zusammenhang folgende generelle Regel: Je ähnlicher der pH-Wert des Eluenten zum pKS-Wert des verwendeten Puffers ist, desto niedriger kann die notwendige Pufferkonzentration sein. Dennoch gilt: Das Dilemma gutes chromatographisches Ergebnis vs. Reinigungs-Aufwand kann nur individuell gelöst werden.
Niederschlag
Eine Verstopfung im Gerät durch einen Niederschlag ist immer ärgerlich. Es liegt auf der Hand, dass diese Gefahr mit steigender Puffer- und Acetonitril-Konzentration sowie bei niedrigen Temperaturen zunimmt. Nachfolgend einige Hinweise:
- Ab ca. 85% Acetonitril in der mobilen Phase und ≥ ca. 20 mM Puffer nimmt das Risiko von Niederschlag im Falle von dünnen, ≤ ca. 0,13 mm Kapillaren stark zu
- „Phosphatpuffer“ – nur welcher? K2HPO4 (Pufferbereich: pH-Wert = 6,5-7,5) macht kaum Probleme, die Löslichkeit ist sehr gut. Na2HPO4 dagegen, insbesondere bei hohem ACN-Anteil und ≤ ca. 25 °C, kann definitiv Probleme bereiten, denn: Die Differenz der Löslichkeit der zwei Salze beträgt mehr als Faktor 20! Im sauren gibt es generell kaum Schwierigkeiten
- Ammoniumacetat bei ≥ ca. 60% ACN: Farblose Kristalle, die beispielsweise in der Mischkammer ausfallen
Die „geeignete“ Vorsäule
Oft wird eine Vorsäule zum Schutz der Hauptsäule eingesetzt. Das Material der Vorsäule muss nicht unbedingt identisch mit dem der Trennsäule sein, es ist Regel-konform, wenn es z. B. auch „C18“ ist. Warum nicht identisch? Die Vorsäule hat in der Regel die Aufgabe, ziemlich „viel“ von der störenden Matrix zu adsorbieren, dabei soll sie nach Möglichkeit wenig Druck aufbauen. Diese Anforderungen führen zu folgenden sinnvollen Charakteristika für eine Vorsäule:
- Gute Beladbarkeit: Dazu soll das Material der Vorsäule eine möglichst große spezifische Oberfläche aufweisen, z. B ≥ 250 m2/g
- Große Bindungskapazität: Die Beladungsdichte des Materials sollte über 3 mMol/m2 der Kohlenstoffgehalt über ca. 18-20% C betragen
- Im Falle von Gradiententrennungen spielt die Teilchengröße eine untergeordnete Rolle. Somit kann die Teilchengröße in der Vorsäule ruhig 5 µm betragen, auch dann, wenn die analytische Säule 3 µm-Teilchen oder kleiner enthält. 5 µm- Teilchen sind haltbarer als 3 µm und bauen einen geringeren Druck auf.
Wird eine Vorsäule nicht zum Schutz der Hauptsäule, sondern zu einer Verbesserung der Trennung von sehr polaren Komponenten – also Elution solcher um oder kurz nach der Totzeit – eingesetzt, sollte das Material natürlich polarer als jenes der Hauptsäule sein. Im Falle einer C18-Hauptsäule kämen somit folgende Phasen für die Vorsäule in Frage:
CN, Phenyl-Hexyl, PFP, Hypercarb, Kieselgel oder Mixed-Mode.
Der Fall Sie arbeiten in einem regulierten Bereich und sind an strenge Prüfvorschriften gebunden. In einer solchen lautet die Forderung: „Auflösung R größer 1,5“, aber gerade diesen Wert erreichen Sie aktuell nicht. Welche regel-konforme Handgriffe kämen in Frage? Die Lösung Was möglich ist, hängt letzten Endes davon ab, wie genau die Angaben in der betreffenden PV sind. Ist in der Tat restlos alles – von der Eluentenzusammensetzung bis zu den Einstellungen („Settings“) – vorgegeben, so können Sie de facto es nur mit einer neuen Säule versuchen. Ist die PV etwas „weicher“, d.h. es sind nur die wichtigsten Parameter wie Säule,…
Der Fall
In den letzten Jahren wurde eine Reihe moderner C18- sowie polarer RP-Phasen eingeführt. Da wären beispielhaft zu nennen: Chemisch geschützte („embedded“ phases), hydrophil endcappede sowie Mixed Mode Phasen und was die Matrix betrifft: Hybrid-, Core Shell- oder monolithische Phasen. Diese Materialien weisen vielfach Vorteile auf. Heißt es nun, dass bei der Entwicklung einer neuen Methode der Einsatz einer solchen modernen Phase die richtige Wahl wäre? Sollte man also nicht-endcappede Phasen als eine alte Technologie „ad acta“ legen?
Die Lösung
Nein. Für die Trennung von Substanzen mit ähnlicher Hydrophobie, aber mit Unterschieden in der Anordnung von Substituenten am Molekül oder von Doppelbindungen in einer Seitenkette (α, β-Isomerie, Stellungsisomerie) oder stark polare Komponenten sind Restsilanolgruppen für die Selektivität sehr wichtig. Dies wird an drei Beispielen demonstriert:
Beispiel 1: Trennung von Steroiden
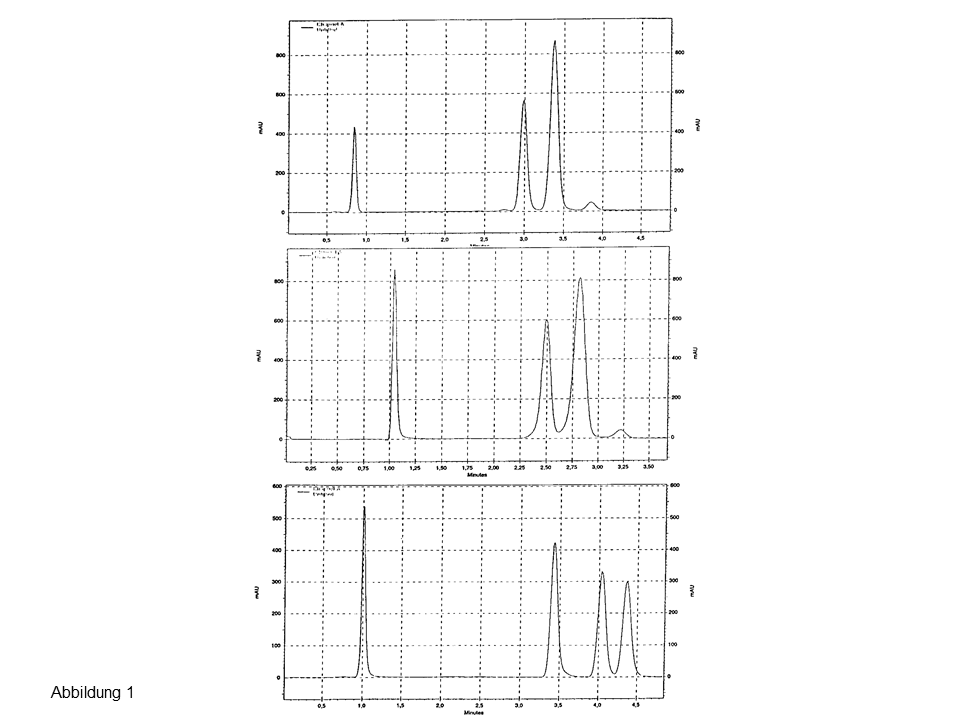
Abb. 1: Trennung von drei Steroiden an zwei endcappeden (oben, Mitte) und an einer nicht endcappeden C18-Phase (unten), Erläuterungen siehe Text.
Das obere und mittlere Chromatogramm zeigen die Injektion von drei Steroiden (α, β-Isomere) an zwei modernen, hydrophoben Phasen. Steroid Nr. 2 und 3 koeluieren. Die Trennung gelingt an Resolve C18, einem älteren, nicht endcappeden Material, siehe unteres Chromatogramm in Abbildung 1.
Beispiel 2: Trennung von starken Basen
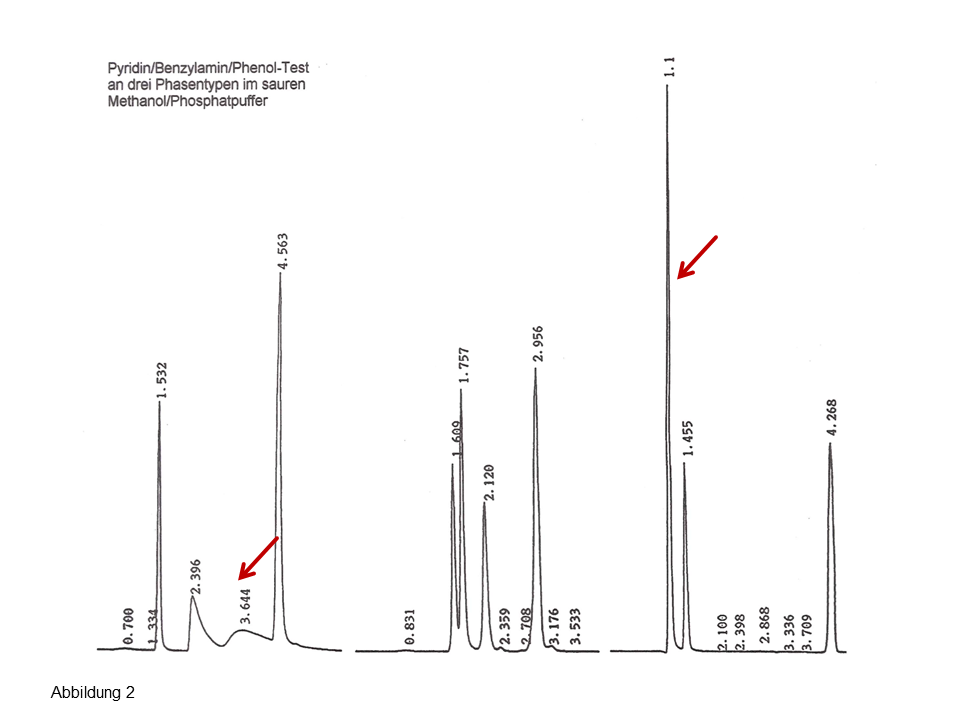
Abb. 2: Injektion einer Mischung von drei polaren Komponenten auf eine silanophile (links) und eine hydrophobe, endcappede C18-Phase (rechts), Erläuterungen, siehe Text.
Auf der rechten Seite der Abbildung 2 wird die Injektion von Uracil (inerte Komponente), Pyridin, Benzylamin und Phenol an einer modernen endcappeden C18-Säule gezeigt. Die zwei Basen koeluieren (erster Peak), was vollkommen nachvollziehbar ist: Man kann nicht erwarten, dass eine hydrophobe, gründlich endcappede Phase eine gute polare Selektivität aufweist. Und das kann zu falschen Schlussfolgerungen führen: Eine gute Peaksymmetrie suggeriert im Routinealltag eine gute Selektivität… Das linke Chromatogramm zeigt die Injektion auf eine „alte“, stark silanophile Phase, Hypersil ODS, das Ergebnis lautet: Eine hervorragende Selektivität für die zwei starke Basen bei gleichzeitig sehr langsamen Kinetik (starkes Tailing). Dass weitere polare Phasen wie beispielsweise eine C7-fluorierte Phase eine ebenso gute Selektivität aufweist (siehe mittleres Chromatogramm) versteht sich von selbst.
Beispiel 3: Injektion einer Mischung diverser Komponenten inkl. drei Isomeren (o-, m-, p-Toluidin)
An mehreren Säulen von Waters erhält man nahezu das gleiche Bild, die Chromatogramme sehen recht ähnlich aus, für die drei Isomere ergeben sich zwei Peaks, siehe Pfeile in Abbildung 3. Erst beim Einsetzen einer nicht-endcappeden Phase (Abbildung 4) sind für die drei Isomere drei Peaks zu sehen. Ferner: Betrachte bei den letzten zwei Peaks die Elutionsumkehr. Auch hier: Eine fluorierte Phase (Abbildung 4, rechts) zeigt eine noch bessere polare Selektivität bei einer noch langsameren Kinetik, siehe dazu das auffallend starke Tailing.
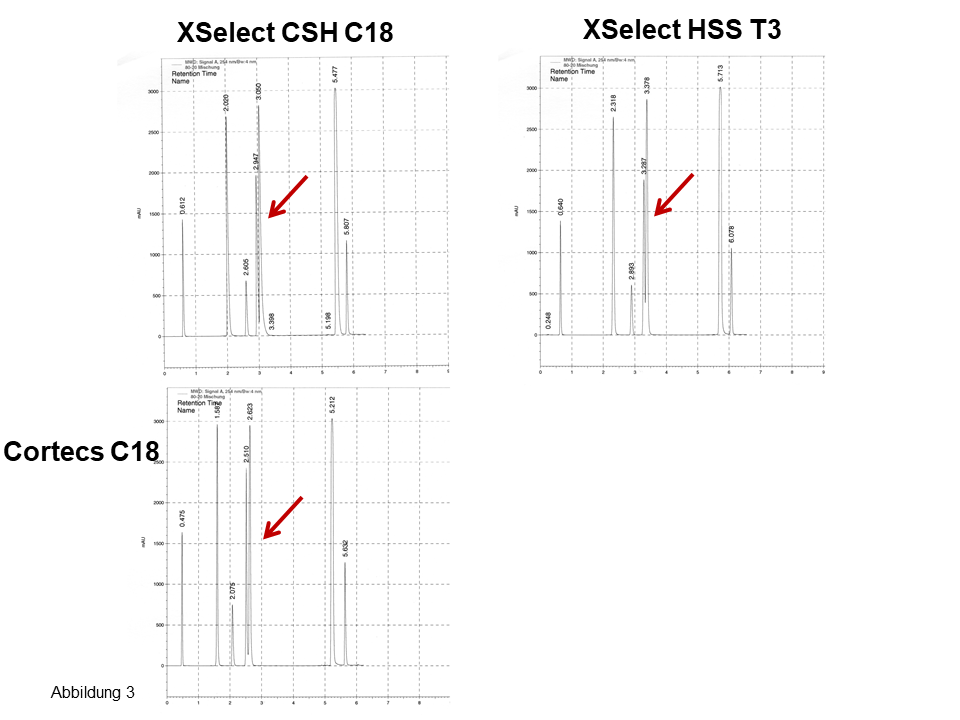
Abb. 3 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
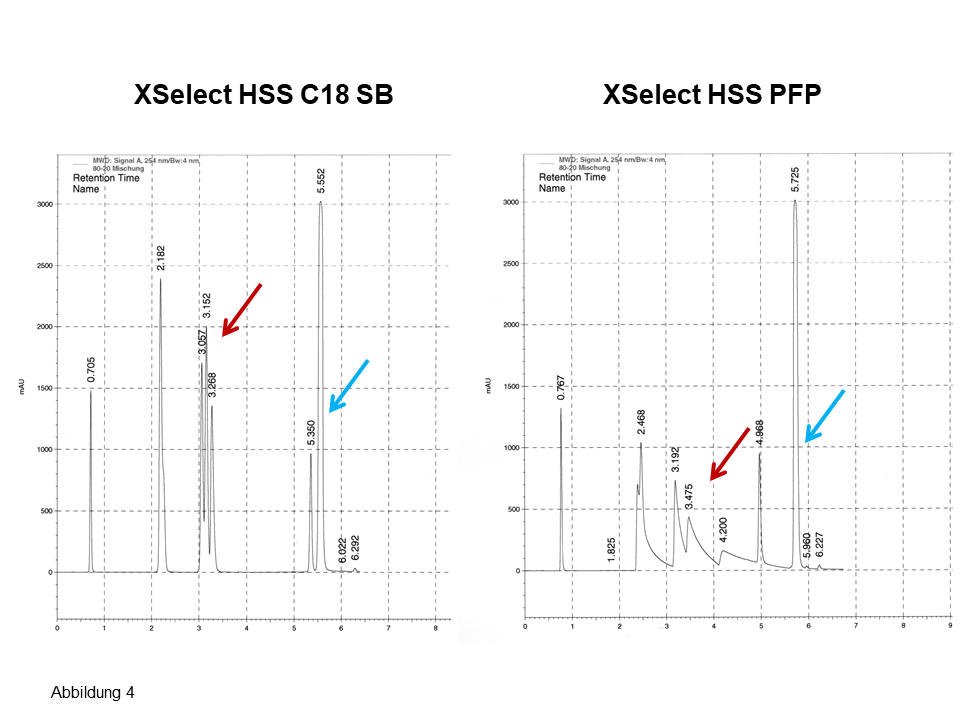
Abb. 4 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
Das Fazit
Für eine Vielzahl üblicher Trennprobleme sind moderne, endcappede Materialien zweifelsohne die richtige Wahl. Es gibt jedoch Fälle, in denen gerade Restsilanolgruppen eine Erhöhung der Selektivität bedingen. Das ist generell der Fall, wenn für die Selektivität zusätzliche Ionenaustausch-Wechselwirkungen notwendig sind wie beispielsweise bei Stellungsisomeren, Phospholipiden und starken Säuren/Basen. Eine evtl. suboptimale Peakform muss oft zu Gunsten einer guten polaren Selektivität in Kauf genommen werden. Es gilt folgende vereinfachte Regel: Je ähnlicher die Moleküle sind, umso notwendiger sind zusätzliche polare/ionische Wechselwirkungen für deren Trennung, umso langsamer die Kinetik bei der Desorption solcher Moleküle von der stationären Phase. Zur Auswahl und zum Vergleich von RP-Säulen siehe „Colona Vergleich und Auswahl von HPLC-RP-Säulen“ , ferner auch das Dokument „Einfache Tests zur Charakterisierung von HPLC-RP-Säulen“.

