Der Fall Wie beim vorherigen HPLC-Tipp geht es auch heute um die Frage, ob ein Peak homogen ist oder womöglich doch eine Koelution vorliegt. Beim letzten Mal haben wir gesehen, dass eine Änderung der Einstellparameter („Settings“) durchaus hilfreich sein kann. Heute steht die Probelösung im Focus: Schnell durchzuführende „Manipulationen“ bzgl. Probelösung können ebenso helfen. Welche wären das? Die Lösung Verdünne die Probelösung oder injiziere weniger Wir alle überladen öfters als gedacht die „arme“ Säule. Ergebnis: Verschlechterung der Auflösung. Eine lokale Überladung der Säule macht sich vor allem am Anfang des Chromatogramms bemerkbar; dort eluieren in einem RP-System polare Komponenten, die zusätzliche polare Wechselwirkungen mit der Oberfläche der stationären Phase eingehen können („Dualer Mechanismus“). Die Devise lautet: Probelösung, also Diluent, einfach mit Wasser verdünnen oder vielleicht noch einfacher: Weniger injizieren. In Abbildung 1, rechts, wird die Injektion von 20 µl Acetophenon gezeigt: Der erste Peak ist eine Verunreinigung, der zweite die Hauptkomponente Acetophenon. Anschließend wurde lediglich Eluent injiziert, linkes Chromatogramm. D.h. hier wurde der Memory-Effekt ausgenutzt: Es befindet sich häufig ein kleiner Rest der Probe an der Nadel, der nicht immer 100% weggespült wird. Wie man leicht erkennt, ist die Verunreinigung sauber, Acetophenon dagegen nicht: Auch mit 20 µl kann eine…
Der Fall Im HPLC-Tipp vom letzten Dezember war Peaky am Zweifeln, ob er es wirklich ist: „Bin ich überhaupt der Peaky? Und wenn ja, wieso fühlt es sich so an, als wäre ich mehrere …“ Es geht also um die Frage, ob ein Peak homogen ist oder womöglich doch eine Koelution vorliegt. Im vorliegenden HPLC-Tipp werden wir uns einfache Tests anschauen, die recht schnell durchzuführen sind: Keine Änderung der chromatographischen Parameter, keine Änderung der Apparatur. In den nächsten HPLC-Tipps werden wir uns sukzessiv mit aufwendigeren Methoden beschäftigen. Die Lösung Eine Veränderung von Einstellparameter („Settings“) kann helfen, innerhalb von Sekunden/Minuten die Peakhomogenität zu überprüfen. Es lohnt sich (auch) an solche „banale“, schnelle Möglichkeiten zu denken: Injektion bei einer anderen (niedrigeren) Wellenlänge, siehe Abbildung 1: Bei 271 nm erscheint der dritte Peak als ein Peak (unteres Chromatogramm), bei 225 nm sind zwei Peaks zu erkennen (oberes Chromatogramm) 2. Eine große Zeitkonstante („Filter Response“, „Filter Time Constant“) führt zwar zu einer ruhigeren Basislinie, die Peakbreite nimmt allerdings zu, man verliert an Auflösung. Folgendes Zahlenbeispiel aus einer „Technical Note“ von Waters, die freundlicherweise von Sascha Schifrin zur Verfügung gestellt wurde: Kein digitales Filtern: Auflösung (Resolution) 3,16, Peakkapazität 16 Zeitkonstante, 0,5 Min: Auflösung 1,82,…
Der Einfluss von Metallionen in der HPLC ist schon seit Längerem bekannt; sprechen wir eher von einem zwar vorhandenen, jedoch bis dato bei vielen Anwender:innen weniger sich stark im Focus befindenden Problem. In den letzten Jahren erlebt dieses Thema allerdings aufgrund der zunehmenden Wichtigkeit von Biomolekülen eine gewisse Renaissance. Um welche Metallionen handelt es sich? Wo kommen sie her und was bewirken sie? Sind sie vermeidbar? Und: Können sie entfernt werden? Doch bevor wir uns dem Thema widmen, zunächst ein kleiner semantischer Exkurs: Konfusion von Begrifflichkeiten Begriffe im hiesigen Zusammenhang werden nicht von allen Beteiligten einheitlich verwendet. Dadurch entsteht eine gewisse Konfusion. Nachfolgend eine kurze Einordnung, wobei diese weder den Anspruch auf Vollständigkeit erhebt, noch kann ich erwarten, dass alle mit dieser 100 % d’accord gehen. Bioinert; geringe Wechselwirkungen mit Hardware-Komponenten, geringes Risiko für carryover; ältester Begriff, bereits 1933 verwendet: Aluminium-Oberfläche als Alternative zu Eisen. Im Umfeld der HPLC sind die verwendeten Materialien hier Titan, Keramik, PEEK Biokompatibel; keine Korrosionsgefahr trotz Chlorid-Ionen im Eluenten; oft synonym bzw. gleich zu setzen mit Bio-LC und Stainless steel-free; verwendete Materialien: Titan und spezielle Legierungen, z. B. MP35N Metall-frei; verwendete Materialien: PEEK, Saphir Weitere anzutreffende Attribute sind: „Inert“, „truly bioinert“ (PEEK), schließlich „fully biocampatible“….
Im – jedenfalls kalendarischen …– Sommer wollen wir uns mit kleinen, knackigen Tipps beschäftigen. Heuer geht es um „die 80 %-Regel“, „Vorteile von Methanol“ und „Mach´ Probelösung und Eluent möglichst ähnlich“. „80%-Regel“ Bei einer Routine-Methode steht i.d.R. Robustheit an erster Stelle, das heißt beispielsweise: Ich erwarte reproduzierbare Ergebnisse und die Säule soll möglichst lange halten. Es hat sich gezeigt, dass ein „Puffer“, also ein Abstand, von ca. 20 % von einem Grenzwert Sicherheit liefert. Nachfolgend einige Beispiele: Einige GPC/SEC-Säulen sind laut Datenblatt bis 100 bar stabil; das Nicht-Überschreiten von 80 bar im Dauerbetrieb beschert eine lange Lebensdauer Manch ‘ein Säulenofen ist von 5 – 80 °C spezifiziert; an beiden Grenzen – also ca. 6 °C sowie ca. 70 °C – ist eine richtige und präzise Temperatur-Einstellung nicht immer gewährleistet. Messungen in diesen Bereichen sind oft nicht reproduzierbar Bei einer Reihe von Säulen wird als pH-Wert-Verträglichkeit der Bereich 2 – 8 angegeben; im Dauerbetrieb würde ich allerdings bei derart spezifizierten stationären Phasen nicht unter ca. pH von 2,4 und nicht über ca. pH 6,5 gehen: Im Sauren können kleine funktionelle Gruppen hydrolysiert werden („Bluten“ der Säule) und ab ca. pH 7,0 kann sich das Kieselgel auflösen. Denke in diesem Zusammenhang auch…
Der Fall
In den letzten Jahren wurde eine Reihe moderner C18- sowie polarer RP-Phasen eingeführt. Da wären beispielhaft zu nennen: Chemisch geschützte („embedded“ phases), hydrophil endcappede sowie Mixed Mode Phasen und was die Matrix betrifft: Hybrid-, Core Shell- oder monolithische Phasen. Diese Materialien weisen vielfach Vorteile auf. Heißt es nun, dass bei der Entwicklung einer neuen Methode der Einsatz einer solchen modernen Phase die richtige Wahl wäre? Sollte man also nicht-endcappede Phasen als eine alte Technologie „ad acta“ legen?
Die Lösung
Nein. Für die Trennung von Substanzen mit ähnlicher Hydrophobie, aber mit Unterschieden in der Anordnung von Substituenten am Molekül oder von Doppelbindungen in einer Seitenkette (α, β-Isomerie, Stellungsisomerie) oder stark polare Komponenten sind Restsilanolgruppen für die Selektivität sehr wichtig. Dies wird an drei Beispielen demonstriert:
Beispiel 1: Trennung von Steroiden
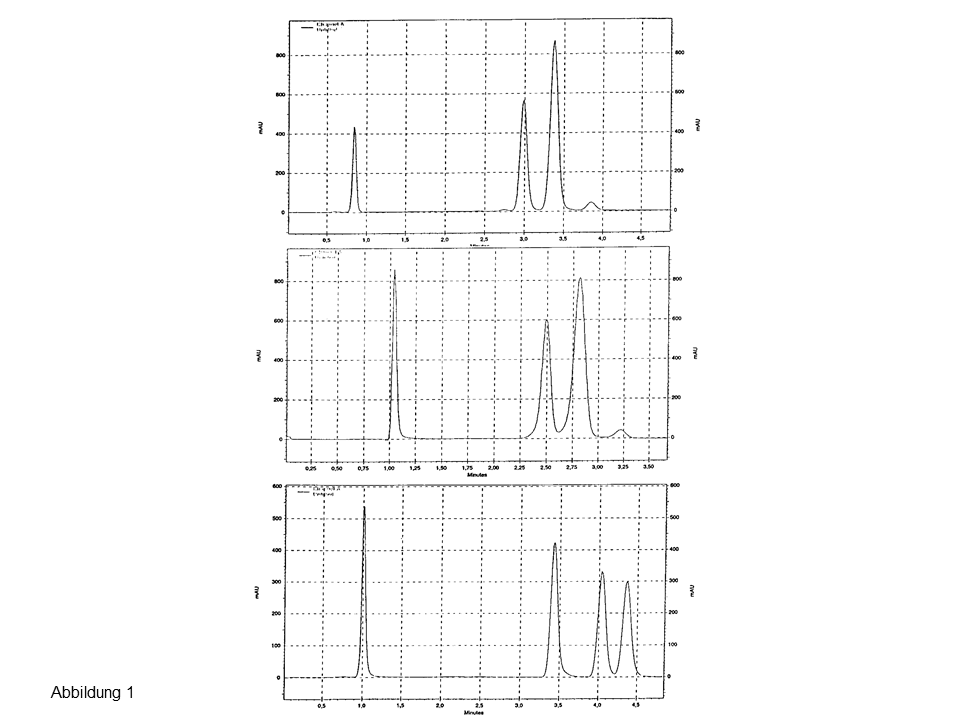
Abb. 1: Trennung von drei Steroiden an zwei endcappeden (oben, Mitte) und an einer nicht endcappeden C18-Phase (unten), Erläuterungen siehe Text.
Das obere und mittlere Chromatogramm zeigen die Injektion von drei Steroiden (α, β-Isomere) an zwei modernen, hydrophoben Phasen. Steroid Nr. 2 und 3 koeluieren. Die Trennung gelingt an Resolve C18, einem älteren, nicht endcappeden Material, siehe unteres Chromatogramm in Abbildung 1.
Beispiel 2: Trennung von starken Basen
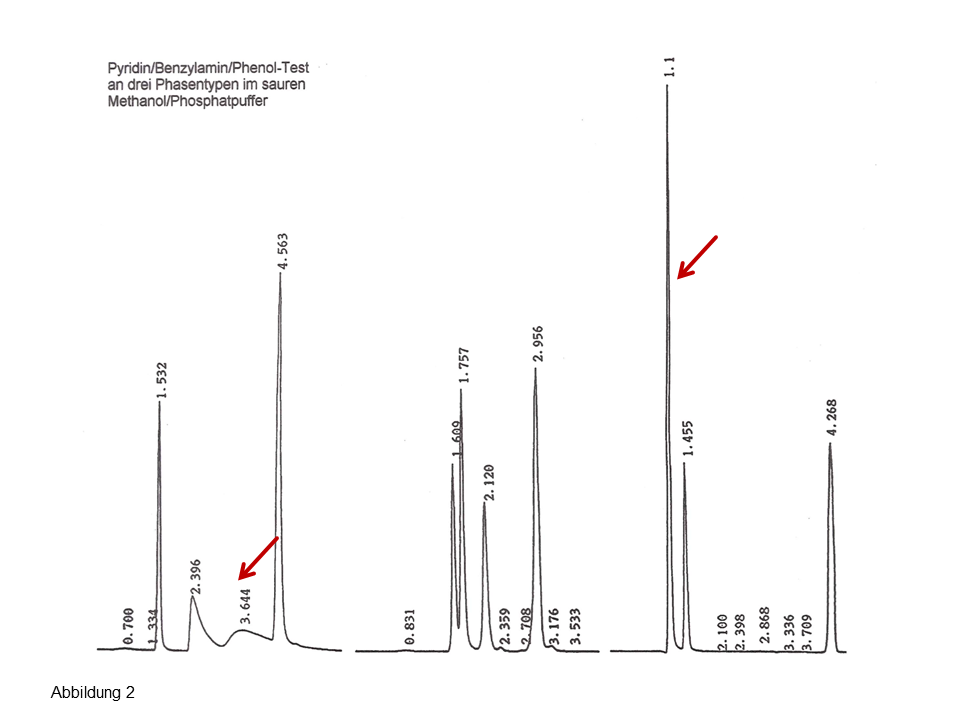
Abb. 2: Injektion einer Mischung von drei polaren Komponenten auf eine silanophile (links) und eine hydrophobe, endcappede C18-Phase (rechts), Erläuterungen, siehe Text.
Auf der rechten Seite der Abbildung 2 wird die Injektion von Uracil (inerte Komponente), Pyridin, Benzylamin und Phenol an einer modernen endcappeden C18-Säule gezeigt. Die zwei Basen koeluieren (erster Peak), was vollkommen nachvollziehbar ist: Man kann nicht erwarten, dass eine hydrophobe, gründlich endcappede Phase eine gute polare Selektivität aufweist. Und das kann zu falschen Schlussfolgerungen führen: Eine gute Peaksymmetrie suggeriert im Routinealltag eine gute Selektivität… Das linke Chromatogramm zeigt die Injektion auf eine „alte“, stark silanophile Phase, Hypersil ODS, das Ergebnis lautet: Eine hervorragende Selektivität für die zwei starke Basen bei gleichzeitig sehr langsamen Kinetik (starkes Tailing). Dass weitere polare Phasen wie beispielsweise eine C7-fluorierte Phase eine ebenso gute Selektivität aufweist (siehe mittleres Chromatogramm) versteht sich von selbst.
Beispiel 3: Injektion einer Mischung diverser Komponenten inkl. drei Isomeren (o-, m-, p-Toluidin)
An mehreren Säulen von Waters erhält man nahezu das gleiche Bild, die Chromatogramme sehen recht ähnlich aus, für die drei Isomere ergeben sich zwei Peaks, siehe Pfeile in Abbildung 3. Erst beim Einsetzen einer nicht-endcappeden Phase (Abbildung 4) sind für die drei Isomere drei Peaks zu sehen. Ferner: Betrachte bei den letzten zwei Peaks die Elutionsumkehr. Auch hier: Eine fluorierte Phase (Abbildung 4, rechts) zeigt eine noch bessere polare Selektivität bei einer noch langsameren Kinetik, siehe dazu das auffallend starke Tailing.
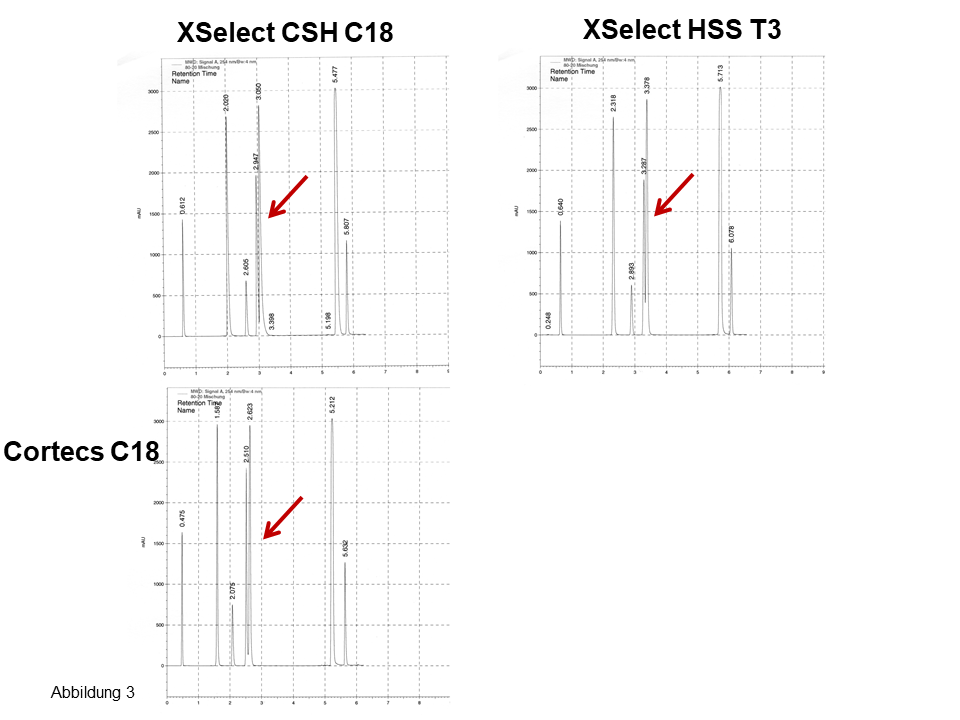
Abb. 3 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
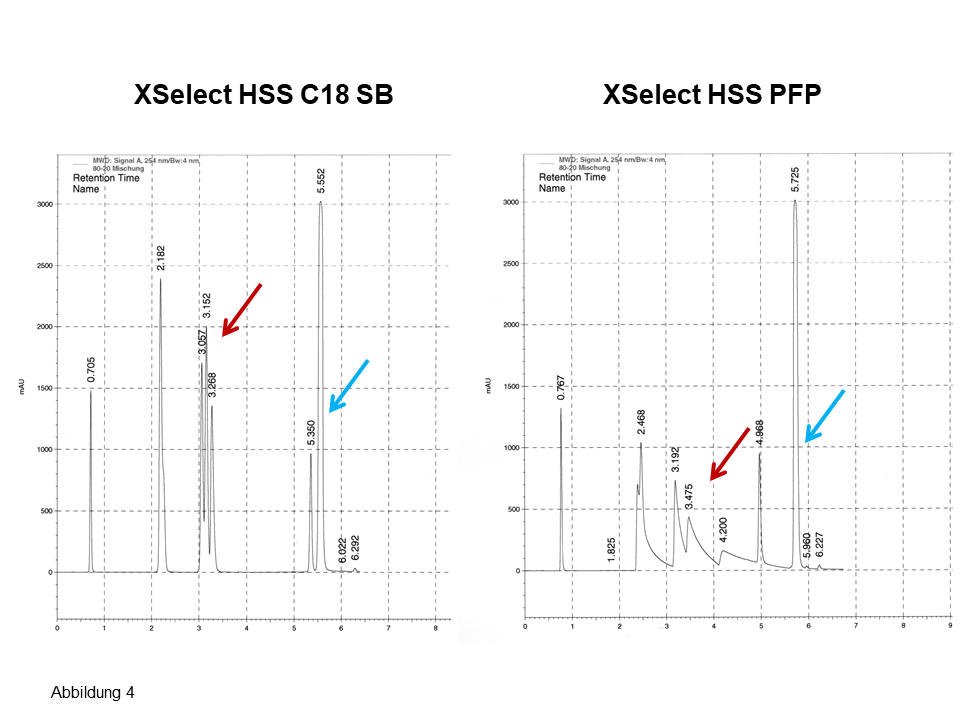
Abb. 4 Trennung von polaren und apolaren Aromaten inkl. Stellungsisomeren, Erläuterung, siehe Text
Das Fazit
Für eine Vielzahl üblicher Trennprobleme sind moderne, endcappede Materialien zweifelsohne die richtige Wahl. Es gibt jedoch Fälle, in denen gerade Restsilanolgruppen eine Erhöhung der Selektivität bedingen. Das ist generell der Fall, wenn für die Selektivität zusätzliche Ionenaustausch-Wechselwirkungen notwendig sind wie beispielsweise bei Stellungsisomeren, Phospholipiden und starken Säuren/Basen. Eine evtl. suboptimale Peakform muss oft zu Gunsten einer guten polaren Selektivität in Kauf genommen werden. Es gilt folgende vereinfachte Regel: Je ähnlicher die Moleküle sind, umso notwendiger sind zusätzliche polare/ionische Wechselwirkungen für deren Trennung, umso langsamer die Kinetik bei der Desorption solcher Moleküle von der stationären Phase. Zur Auswahl und zum Vergleich von RP-Säulen siehe „Colona Vergleich und Auswahl von HPLC-RP-Säulen“ , ferner auch das Dokument „Einfache Tests zur Charakterisierung von HPLC-RP-Säulen“.
Der Fall Mithilfe von SSTs wird überprüft, ob diese Methode an diesem Gerät „hier und jetzt“ funktioniert. Ob also die Anforderungen an diese Methode erfüllt werden oder eben nicht. Als Forderung kann beispielsweise ein bestimmter Wert für die Auflösung eines kritischen Paars oder die Bestimmungsgrenze für eine Nebenkomponente gelten. Sind weitere Tests notwendig zumal ja die Zeit immer knapper wird? Die Lösung Sicherlich gibt es hier unterschiedliche Vorstellungen. Nachfolgend meine persönliche Meinung und davon ableitend ein Vorschlag: Ein gut designter SST beinhaltet die Information, die ich brauche. Passt er, so ist nichts mehr zu tun. Passt er nicht, so wären…
„Was sollte ich denn machen, die hatten nur Vodka…“ Folgende Anekdote eines Kollegen aus den Anfängen der HPLC: Er war um 1980 herum in der Sowjetunion auf Kundenreise. Im tiefsten Sibirien angekommen, wollte er nach einem Kundengespräch als Beleg für das Besprochene auch ein paar praktische Versuche durchführen – manch einer war logischerweise etwas misstrauisch gegenüber Versprechungen aus dem Westen… Damals war es mit dem Zoll noch schwieriger als heute, er konnte gerade zwei Säulen dabei haben, es waren je eine 25 cm lange Spherisorb C8 bzw. Spherisorb CN. Mit MeOH und ACN war natürlich „nichts“, aber Vodka, davon war…
Schauen wir uns die in diesem Tipp beschriebenen Fälle an: Dieser Aktion folgt dieses Ergebnis – wieso eigentlich (II)? Leckage am UV-Detektor – was stelle ich fest? Doppeltes Injektionsvolumen – doppelte Peakfläche? Flussänderung – bleibt die Peakfläche konstant? Mehr Wasser im Eluenten ; eluieren die Peaks später, und wenn ja, warum? Wieso eluiert eine starke Base an einer stark belegten C18-Phase später als eine neutrale Komponente? Mehr Acetonitril im Eluenten, die Peaks eluieren früher; wird die Trennung schlechter? Peakfläche und konzentrationsabhängiger Detektor 1. Nehmen wir an, am Eingang zum Detektor tritt eine Leckage auf und ein Teil der Probe geht dadurch verloren. In…
Dieser Aktion folgt dieses Ergebnis – wieso eigentlich (I)? Leckage am UV-Detektor – was stelle ich fest? Doppeltes Injektionsvolumen – doppelte Peakfläche? Flussänderung – bleibt die Peakfläche konstant? Mehr Wasser im Eluenten ; eluieren die Peaks später, und wenn ja, warum? Wieso eluiert eine starke Base an einer stark belegten C18-Phase später als eine neutrale Komponente? Mehr Acetonitril im Eluenten, die Peaks eluieren früher; wird die Trennung schlechter? Betätigen wir uns gerade ein wenig „sportlich“ und betrachten nun folgende Situationen: Jeder von uns macht in seinem (HPLC-) Alltag mechanisch Handgriffe, die richtig und dienlich sind; auch werden erwartete Ergebnisse als selbstverständlich angesehen –…
Der Fall In diesem HPLC-Tipp haben wir uns darüber unterhalten, dass bestimmte Komponenten durch Adhäsion an vielen Oberflächen ganz oder teilweise irreversibel haften bleiben können. Deswegen sollte man im Falle des Falles auch an unwichtig anmutende Änderungen oder Unterschiede in den Abläufen und in den Utensilien von Labor zu Labor denken. Heute wollen wir schauen, welche, eher chemische Ursachen infrage kommen, wenn eben nur ein Peak (oder auch zwei) im Chromatogramm Probleme bereitet(en). Die Lösung Vorweg: Vermutlich ist der pH-Wert oder – genauer – seine Veränderung die wichtigste Ursache für das hier besprochene Problem und hier wiederum dürften folgende zwei…

